Tuyển tập lý thuyết và bài tập cơ bản Hóa 8 học kì 1
Nội dung tài liệu
Tải xuốngCác tài liệu liên quan
-
![Đề cương ôn thi học kì 1 Hóa 8]()
-
![Đề cương ôn tập học kì 1 Hóa 8 trường THCS Tân Tiến năm 2019-2020]()
-
![Tuyển tập lý thuyết và bài tập cơ bản Hóa 8 học kì 1]()
-
![CHƯƠNG 2 PHẢN ỨNG HÓA HỌC]()
-
![HOÁ 8 HKI(10-11)]()
-
![Đề cương ôn tập cuối kì 1 Hóa 8]()
-
![Bài tập sơ đồ phản ứng và nhận biết]()
-
![BÀI TẬP TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC]()
-
![BÀI TOÁN LƯỢNG CHẤT DƯ]()
-
![Nội dung ôn thi học kì II Hóa học 8]()
Có thể bạn quan tâm
Thông tin tài liệu
PHẦN LÝ THUYẾT HỌC KỲ I
1. Khái niệm nguyên tử, phân tử, nguyên tử khối, phân tử khối.
- Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm :
- Hạt nhân tạo bởi proton(p) và nơtron
- Trong mỗi nguyên tử : p(+) = e (-)
- Electron luôn chuyển động quanh hạt nhân và sắp xếp thành từng lớp.
- Nguyên tố hóa học là tập hợp những nguyên tử cùng loại, có cùng số p trong hạt nhân.
- Kí hiệu hóa học biểu diễn nguyên tố và chỉ một nguyên tử của nguyên tố đó.
Nguyên tử khối là khối lượng của nguyên tử tính bằng đơn vị cacbon. Mỗi nguyên tố có nguyên tử khối riêng biệt.
- Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất.
- Phân tử là hạt hợp thành của hầy hết các chất,các đơn chất kim loại… có hạt hợp thành là nguyên tử.
- Phân tử khối là khối lượng của phân tử tính bằng đơn vị cacbon, bằng tổng nguyên tử khối của các nguyên tử trong phân tử.
2. Thế nào là đơn chất , hợp chất. Cho ví dụ?
- Đơn chất là những chất tạo nên từ một nguyên tố hóa học. Ví dụ : khí hiđro, lưu huỳnh, kẽm, natri,…
- Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên. Ví dụ : Nước tạo nên từ hai nguyên tố hóa học là H và O.
3. Công thức hóa học dùng biểu diễn chất :
+ Đơn chất : A ( đơn chất kim loại và một vài phi kim như : S,C … )
+ Đơn chất : Ax ( phần lớn đơn chất phi kim, thường x = 2 )
+ Hợp chất : AxBy ,AxByCz …
- Mỗi công thức hóa học chỉ một phân tử của chất ( trừ đơn chất A ) và cho biết :
+ Nguyên tố tạo ra chất.
+ Số nguyên tử của mỗi nguyên tố và phân tử khối.
4. Phát biểu quy tắc hóa trị . Viết biểu thức.
- Hóa trị của nguyên tố ( hay nhóm nguyên tử ) là con số biểu thị khả năng liên kết của nguyên tử ( hay nhóm nguyên tử ), được xác định theo hóa trị của H chọn làm một đơn vị và hóa trị của O là hai đơn vị
- Quy tắc hóa trị : Trong công thức hóa học,tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
- Biểu thức :
x × a = y × b . B có thể là nhóm nguyên tử,ví dụ : Ca(OH)2 ,ta có 1 × II = 2 × 1
Vận dụng :
+ Tính hóa trị chưa biết : biết x,y và a ( hoặc b) tính được b (hoặc a)
+ Lập công thức hóa học khi biết a và b :
- Viết công thức dạng chung
- Viết biểu thức quy tắc hóa trị, chuyển tỉ lệ :
Lấy x = b hoặc b’ và y = a hay a’ ( Nếu a’,b’ là những số nguyên đơn giản hơn so với a,b)
6.Sự biến đổi của chất :
- Hiện tượng chất biến đổi mà vẫn giữ nguyên là chất ban đầu được gọi là hiện tượng vật lý.
- Hiện tượng chất biến đổi có tạo ra chất khác, được gọi là hiện tượng hóa học.
7.Phản ứng hóa học :
- Phản ứng hóa học là quá trình biến đổi từ chất này thành chất k=hác.
- Trong phản ứng hóa học chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
- Phản ứng xảy ra được khi các chất tham gia tiếp xúc với nhau, có trường hợp cần đun nóng, có trường hợp cần chất xúc tác.
- Nhận biết phản ứng xảy ra dựa vào dấu hiệu có chất mới tạo thành : Có tính chất khác như màu sắc,trạng thái. Hoắc sự tỏa nhiệt và phát sáng.
8. Định luật bảo toàn khối lượng : A + B → C + D
- Định luật : Trong một phản ứng hóa hoc, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng.
- Biếu thức : mA + mB = mC + mD
9. Phương trình hóa học : biểu diễn ngắn gọn phản ứng hóa học.
- Ba bước lấp phương trình hóa học : Viết sơ đồ phản ứng,Cân bằng phương trình, Viết phương trình hóa học
- Phương trình hóa học cho biết tỉ lệ về số nguyên tử, số phân tử giữa các chất cũng như từng cặp chất trong phản ứng.
8. Các công thức chuyển đổi giữa khối lượng, thể tích và lượng chất.
- Mol (n) là lượng chất có chứa N nguyên tử hoặc phân tử của chất đó.
con số 6.1023 là số Avogađro, kí hiệu là N
- Khối lượng mol (M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó
- Thể tích mol (l) của chất khí là thể tích chiếm bơi N phân tử của chất khí đó.
rút ra
- Thể tích khí chất khí : + Ở điều kiện tiêu chuẩn : = (l)
+ Ở điều kiện thường : V = n × 24 = (l)
9. Tỷ khối của chất khí.
- Khí A đối với khí B : - Khí A đối với không khí :
TÓM TẮT KIẾN THỨC CƠ BẢN HỌC KÌ II
CHƯƠNG IV: OXI – KHÔNG KHÍ
I/ TÍNH CHẤT CỦA OXI:
1/ Tính chất vật lý: Oxi là chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí. Oxi hóa lỏng ở -183 0C . Oxi lỏng có màu xanh nhạt.
2/ Tính chất hóa học: Khí oxi là 1 đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Ví dụ:
II/ SỰ OXI HÓA – PHẢN ỨNG HOÁ HỢP - ỨNG DỤNG CỦA OXI:
1. Sự tác dụng của oxi với 1 chất là sự oxi hóa
2. Phản ứng hoá hợp là phản ứng hóa học trong đó chỉ có 1 chất mới (sản phẩm) được tạo thành từ hai hay nhiều chất ban đầu.
Ví dụ:
3.Ứng dụng của oxi: Khí oxi cần cho sự hô hấp của người và động vật, cần để đốt nhiên liệu trong đời sống và sản xuất.
III/ OXIT:
1.Định nghĩa oxit: Oxit là hợp chất của 2 nguyên tố, trong đó có 1 nguyên tố là oxi
Vd: K2O, Fe2O3, SO3, CO2….
2.Công thức dạng chung của oxit MxOy
- M: kí hiệu một nguyên tố khác (có hóa trị n)
- Công thức MxOy theo đúng quy tắc về hóa trị. n.x = II.y
3. Phân loại: Gồm 2 loại chính: oxit axit và oxit bazơ
Vd: Oxit axit: CO2, SO3, P2O5…. Oxit bazơ: K2O,CaO, ZnO…
4. Cách gọi tên oxit :
a. Oxit bazơ: Tên oxit = tên kim loại(kèm theo hóa trị) + oxit.
VD: K2O: kali oxit CuO: đồng (II) oxit
b. Oxit axit
Tên oxit = tên phi kim (kèm tiền tố chỉ số nguyên tử phi kim) + oxit (kèm tiền tố chỉ số nguyên tử oxi)
VD: N2O5: đinitơ pentaoxit SiO2: silic đioxit
IV/ ĐIỀU CHẾ OXI – PHẢN ỨNG PHÂN HỦY:
1/ Điều chế khí oxi trong phòng thí nghiệm:
- Nhiệt phân những chất giàu oxi và dễ bị phân hủy ra oxi (KMnO4, KClO3 …)
- Cách thu: + Đẩy không khí + Đẩy nước.
PTPƯ:
2/ Sản xuất khí oxi trong công nghiệp: dùng nước hoặc không khí.
- Cách điều chế:
+ Hoá lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lỏng bay hơi sẽ thu được khí nitơ ở -1960C sau đó là khí oxi ở -1830C
+ Điện phân nước
3/ Phản ứng phân hủy: là phản ứng hoá học trong đó 1 chất sinh ra hai hay nhiều chất mới.
Vd:
- Nhận ra khí O2 bằng tàn đóm đỏ, O2 làm tàn đóm đỏ bùng cháy.
V/ KHÔNG KHÍ – SỰ CHÁY:
1.Thành phần của không khí: không khí là hỗn hợp nhiều chất khí. Thành phần theo thể tích của không khí là: 78 % khí nitơ, 21% khí oxi, 1% các chất khí khác ( khí cacbonic, hơi nước, khí hiếm…)
2. Sự cháy: là sự oxi hóa có tỏa nhiệt và phát sáng
3. Sự oxi hoá chậm: là sự oxi hóa có tỏa nhiệt nhưng không phát sáng
CHƯƠNG V: HIĐRO – NƯỚC
I/ TÍNH CHẤT CỦA HIĐRO :
1/ Tính chất vật lý: Hiđro là chất khí, không màu, không mùi, tan rất ít trong nước, nhẹ nhất trong các khí
2/ Tính chất hóa học: Khí hiđro có tính khử, ở nhiệt độ thích hợp, hiđro không những kết hợp được với đơn chất oxi, mà nó còn có thể kết hợp với nguyên tố oxi trong 1 số oxit kim loại. Các phản ứng này đều tỏa nhiều nhiệt.
VD: a/ b/
II/ PHẢN ỨNG OXI HÓA KHỬ:
- Sự khử là sự tách oxi ra khỏi hợp chất. Sự oxi hóa là sự tác dụng của oxi với 1 chất
- Chất chiếm oxi của chất khác là chất khử. Chất nhường oxi cho chất khác là chất oxi hóa.
- Phản ứng oxi hóa – khử là phản ứng hoá học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
VD: Sự oxi hóa H2 Sự oxi hóa H2
HgO + H2 Hg + H2O 2H2 + O2 2 H2O
(c.oxh) (c.k) (c.k) (c.oxh)
Sự khử HgO sự khử O2
III/ ĐIỀU CHẾ KHÍ HIĐRO – PHẢN ỨNG THẾ:
1/ Trong phòng thí nghiệm: Khí H2 được điều chế bằng cách cho axit ( HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm)
PTHH:
- Thu khí H2 bằng cách đẩy nước hay đầy không khí.
- Nhận ra khí H2 bằng que đóm đang cháy, H2 cháy với ngọn lửa màu xanh
2/ Trong công nghiệp:
- Điện phân nước:
- Khử oxi của H2O trong khí than:
3/Phản ứng thế: Là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của 1 nguyên tố khác trong hợp chất
VD: Fe +H2SO4 FeSO4+H2
IV/ NƯỚC:
1/ Thành phần hóa học của nước:
Nước là hợp chất tạo bởi 2 nguyên tố là hiđro và oxi.
- Chúng hóa hợp:
+ Theo tỉ lệ về thể tích là 2 phần hiđro và 1 phần oxi
+ Theo tỉ lệ về khối lượng là 1 phần hiđro và 8 phần oxi
2/ Tính chất của nước:
a/ Tính chất vật lý: Nước là chất lỏng, không màu, không mùi, không vị, sôi ở 1000C, hóa rắn ở 00C,
d =1g/ml, hòa tan được nhiều chất rắn, lỏng, khí
b/ Tính chất hóa học:
* Tác dụng với kim loại: Nước tác dụng với 1 số kim loại ở nhiệt độ thường ( như Na, K, Ca,…) tạo thành bazơ và hiđro. Vd:
* Tác dụng với 1 số oxit bazơ
- Nước tác dụng với 1 số oxit bazơ tạo thành bazơ. Dung dịch bazơ làm đổi màu quì tím thành xanh.
VD:
*/ Tác dụng với 1 số oxit axit:
- Nước tác dụng với 1 số oxit axit tạo thành axit. Dung dịch axit làm đổi màu quì tím thành đỏ.
VD:
V/ AXIT – BAZƠ – MUỐI:
1/ AXIT:
1/ Định nghĩa:Axit là hợp chất mà phân tử gồm 1 hay nhiều nguyên tử hiđro liên kết với gốc axit
2/ Phân loại và gọi tên:
a/ Axit không có oxi: HCl, H2S, HBr, HF…
Tên axit = Axit + tên phi kim + hiđric VD: HCl: axit clohiđric
b/ Axit có oxi: H2SO4, HNO3, H3PO4, H2CO3…..
** Axit có nhiều nguyên tử oxi:Tên axit = Axit + tên phi kim + ic
VD: H2SO4: axit sunfuric
** Axit có ít nguyên tử oxi:Tên axit = Axit + tên phi kim + ơ
VD: H2SO3: axit sunfurơ
2/ BAZƠ:
1/ Định nghĩa: Bazơ là hợp chất mà phân tử gồm 1 nguyên tử kim loại liên kết với 1 hay nhiều nhóm hiđroxit (- OH)
2/ Phân loại và gọi tên:
- Dựa vào tính tan trong nước, bazơ chia làm 2 loại:
+ Bazơ tan gọi là kiềm ( Vd: NaOH, KOH, Ca(OH)2,…..)
+ Bazơ không tan (Vd: Cu(OH)2, Mg(OH)2, Al(OH)3,…..)
- Tên bazơ = tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + hiđrôxit.
VD: NaOH : natri hiđroxit Fe(OH)3 : sắt (III) hiđroxit
3/ MUỐI:
1/ Định nghĩa: Muối là hợp chất mà phân tử gồm có nguyên tử kim loại liên kết với gốc axit
2/ Phân loại và gọi tên:
- Dựa vào thành phần phân tử, muối chia làm 2 loại:
+ Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hiđro (Vd: NaCl, CaCO3,…)
+ Muối axit: là muối mà trong gốc axit còn có nguyên tử hiđro (Vd: NaH2PO4, Na2HPO4,…)
- Tên muối = tên kim loại (kèm hóa trị nếu kim loại nhiều hóa trị) + tên gốc axit
VD: Al2(SO4)3 : nhôm sunfat KHCO3: kali hiđrocacbonat
CHƯƠNG VI: DUNG DỊCH
I/ DUNG DỊCH:
- Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan
- Ở nhiệt độ xác định:
+ Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan
+ Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan
- Muốn chất rắn tan nhanh trong nước, ta thực hiện 1, 2 hoặc cả 3 biện pháp sau:khuấy dung dịch, đun nóng dung dịch, nghiền nhỏ chất rắn.
II/ ĐỘ TAN CỦA MỘT CHẤT TRONG NƯỚC:
- Độ tan (S) của 1 chất là số gam chất đó tan được trong 100g nước để tạo thành dung dịch bão hòa ở 1 nhiệt độ xác định.
- Độ tan của chất rắn sẽ tăng nếu tăng nhiệt độ. Độ tan của chất khí sẽ tăng nếu giảm nhiệt độ và tăng áp suất
III/ NỒNG ĐỘ DUNG DỊCH:
- Nồng độ phần trăm cho biết số gam chất tan có trong 100g dung dịch:
- Nồng độ mol cho biết số mol chất tan trong 1 lít dung dịch:
Một số phương pháp giải toán hóa 8
1. Phöông phaùp giaûi baøi toaùn hoaù:
- Vieát PT caân baèng
-Tính soá mol ñeà cho
- Suy dieãn caùc soá mol
-Tính theo yeâu caàu cuûa ñeà
2. Caùc böôùc laäp PTHH:
- Vieát sô ñoà PÖ , Xaùc ñònh chaát tham gia, saûn phaåm
- Caân baèng soá nguyeân töûmoãi nguyeân toá: heä soá thích hôïp
- Vieát PTHH ñaày ñuû
3. Xaùc ñònh thaønh phaàn % caùc nguyeân toá trong hôïp chaát:
- Tìm khoái löôïng mol cuûa hôïp chaát.
- Tính soá mol nguyeân töû moãi nguyeân toá
-Tính phaàn traêm caùc nguyeân toá trong hôïp chaát
4. Xaùc ñònh coâng thöùc khi bieát thaønh phaàn caùc nguyeân toá:
- Tìm khoái löôïng moãi nguyeân toá coù trong moät mol hôïp chaát
- Tìm soá mol cuûa moãi nguyeân toá
- Vieát coâng thöùc caàn tìm
5 . Tính tan cuûa moät soá chaát trong nöôùc:
* A xit : Haàu heát ñeàu tan trong nöôùc ( tröø H2SiO3)
* Bazô: Phaàn lôùn laø khoâng tan trong nöôùc tröø moät soá kim loaïi kieàm: NaOH, Ba(OH)2, Ca(OH)2...ít tan.
* Muoái:
- Haàu heát caùc muoái Na, K ñeàu tan
- Caùc muoái Nitrat ñeàu tan.
- Phaàn lôùn caùc muoái Clo rua, Sun fat ñeàu tan tröø AgCl2, PbCl2, BaSO4, PbSO4
- Caùc muoái cacbonat ñeàu tan
6. Laäp coâng thöùc hoaù hoïc khi bieát hoaù trò:
- Ñaët coâng thöùc caàn laäp: Aax Bby
- Theo quy taéc hoaù trò : X * a = Y * b
- Laäp tæ leä : = X = b , Y = a
- Laäp coâng thöùc caàn tìm: Ax By = AbBa
BAÛNG 1- MOÄT SOÁ NGUYEÂN TOÁ HOAÙ HOÏC
| Soáproton | Teân nguyeân toá | Kí hieäu hoaù hoïc | Nguyeân tử khoái | Hoaù trò |
|---|---|---|---|---|
| 1 | Hiñro | H | 1 | I |
| 2 | Heli | He | 4 | |
| 3 | Liti | Li | 7 | I |
| 4 | Beri | Be | 9 | II |
| 5 | Bo | B | 11 | III |
| 6 | Cacbon | C | 12 | II,IV |
| 7 | Nitô | N | 14 | II,III,IV,... |
| 8 | Oxi | O | 16 | II |
| 9 | Flo | F | 19 | I |
| 10 | Neon | Ne | 20 | |
| 11 | Natri | Na | 23 | I |
| 12 | Magie | Mg | 24 | II |
| 13 | Nhoâm | Al | 27 | III |
| 14 | Silic | Si | 28 | IV |
| 15 | Phoâtpho | P | 31 | II,V |
| 16 | Löu huyønh | S | 32 | II,IV,VI |
| 17 | Clo | Cl | 35,5 | I,... |
| 18 | Agon | Ar | 39,9 | |
| 19 | Kali | K | 39 | I |
| 20 | Canxi | Ca | 40 | II |
| . | ||||
| . | ||||
| 24 | Crom | Cr | 52 | II,III... |
| 25 | Mangan | Mn | 55 | II,IV,VII... |
| 26 | Saét | Fe | 56 | II,III |
| 29 | Ñoàng | Cu | 64 | I,II |
| 30 | Keõm | Zn | 65 | II |
| 35 | Brom | Br | 80 | I... |
| 47 | Baïc | Ag | 108 | I |
| 56 | Bari | Ba | 137 | II |
| 80 | Thuyû ngaân | Hg | 201 | I,II |
| 82 | Chì | Pb | 207 | II,IV |
BẢNG TÍNH TAN TRONG NƯỚC CỦA CÁC AXIT- BAZƠ- MUÔI
| Nhóm hiđroxit và gốc axit | HIĐRO VÀ CÁC KIM LOẠI | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
H I |
K I |
Na I |
Ag I |
Mg II |
Ca II |
Ba II |
Zn II |
Hg II |
Pb II |
Cu II |
Fe II |
Fe III |
Al III |
|
| -OH | t | t | - | k | i | t | k | - | k | k | k | k | k | |
| -Cl | t/b | t | t | k | t | t | t | t | t | i | t | t | t | t |
| -NO3 | t/b | t | t | t | t | t | t | t | t | t | t | t | t | t |
| =S | t/b | t | t | k | - | t | t | k | k | k | k | k | k | - |
| =SO3 | t/b | t | t | k | k | k | k | k | k | k | k | k | - | - |
| =SO4 | t/kb | t | t | i | t | i | k | t | - | k | t | t | t | t |
| =CO3 | t/b | t | t | k | k | k | k | k | - | k | - | k | - | - |
| =SiO3 | t/kb | t | t | - | k | k | k | k | - | k | - | k | k | k |
| (PO4)3 | t/kb | t | t | k | k | k | k | k | k | k | k | k | k | k |
| -Br | t/b | t | t | k | t | t | t | t | i | i | t | t | t | t |
| -I | t/b | t | t | k | t | t | t | t | k | k | - | t | - | t |
t: hợp chất tan được trong nước k : hợp chất không tan b: hợp chất không bay hơi.
i: ít tan b: hợp chất bay hơi hoặc dễ phân hủy thành khí bay lên
vạch ngang “- ” : hợp chất không tồn tại hoặc bị phân hủy trong nước.
Nhận xét:
- Hầu hết các axit tan được trong nước, trừ axit silixic ( H2SiO3)
- Phần lớn các bazơ không tan trong nước, trừ một số như : NaOH, KOH, LiOH, Ba(OH)2; còn Ca(OH)2 ít tan.
- Những muối natri, kali đều tan.
- Những muối nitrát ( NO3) đều tan.
- Phần lớn các muối clo rua, iotua, suanfat tan được.
- Phần lớn các muối sunfat, cacbonat, sunfit, phôtphat, silicat không tan hoặc bị phân hủy.
PHẦN BÀI TẬP
CHƯƠNG I. CHẤT-NGUYÊN TỬ-PHÂN TỬ
BÀI 2. CHẤT
1.1 Hãy chỉ ra đâu là vật thể, là chất trong các câu sau:
a. Cơ thể người có từ 63 ÷ 68% về khối lượng là nước.
b. Dây điện làm bằng đồng được bọc một lớp chất dẻo.
c. Không khí gồm oxi, nitơ, khí cacbonic ...
d. Nhiều xoong, nồi, ấm đun được làm bằng nhôm.
e. Chậu có thể làm bằng nhôm hay chất dẻo.
1.2 Hãy cho biết đâu là tính chất vật lý, tính chất hóa học của rượu etylic trong các câu sau: Rượu etylic là chất lỏng, không màu, sôi ở 78oC, nhẹ hơn nước, tan vô hạn trong nước. Rượu etylic cháy trong oxi tạo ra khí cacbonic và hơi nước.
1.3. Điền từ hoặc cụm từ thích hợp cào chỗ trống:
Các vật thể………………….đều gồm một số …………………khác nhau,………được làm ra từ vật liệu. Mọi vật liệu đều là ……………..hay hoonc hợp một số ………………………. Nên ta nói đươc: Đâu có ………………là có …………………
1.4. Hãy phân biệt từ nào ( những từ in nghiêng) chỉ vật thể tự nhiên, vật thể nhân tạo, hay chất trong các câu sau đây:
a. Trong quả chanh có nước , axit xitric ( có vị chua) và một số chất khác.
b. Cốc bằng thủy tinh dễ vỡ so với cốc bằng chất dẻo.
c. Thuốc đầu que diêm được trộn một ít lưu huỳnh.
d. Quặng apatit ở Lao Cai có chứa canxi phootphat với hàm lượng cao.
e. Bóng đèn điện được chế tạo từ thủy tinh, đồng và vonfam ( một kim loại chịu nóng , làm dây tóc ).
1.5. Cồn( rượu etylic) là một chất lỏng, có nhiệt độ sôi t0S = 78,30 C và tan nhiều trong nước.
Làm thế nào để tách riêng được cồn từ hỗn hợp cồn và nước.
1.6 .Kim loại thiếc có nhiệt độ nóng chảy xác định là : t0nc=232 0C . Thiếc hàn nóng chảy ở khoảng 1800C. Vậy thiếc hàn là chất tinh khiết hay có lẫn chất khác. ?
BÀI 4. NGUYÊN TỬ
2.1. Chọn những câu phát biểu đúng trong số các câu sau:
a. Các chất đều được tạo nên từ những hạt vô cùng nhỏ, trung hòa điện gọi là nguyên tử.
b. Nguyên tử được tạo bởi những hạt nhỏ hơn và không mang điện là proton, nơtron và electron.
c. Hạt nhân nguyên tử tạo bởi proton và nơtron. Số proton bằng số nơtron.
d. Vỏ nguyên tử tạo bởi một hay nhiều electron mang điện tích âm.
e. Các nguyên tử cùng loại đều có cùng số proton và số nơtron trong hạt nhân.
f. Trong nguyên tử, số proton bằng số electron.
g. Các hạt proton, nơtron và electron đều có cùng khối lượng.
h. Trong nguyên tử, electron luôn chuyển động rất nhanh xung quanh hạt nhân và sắp xếp thành từng lớp, mỗi lớp có một số electron nhất định.
i. Nhờ có electron mà các nguyên tử có thể liên kết được với nhau.
2.2. Tổng số hạt proton, nơtron, electron trong nguyên tử là 28, trong đó số hạt không mang điện chiếm xấp xỉ 35%. Tính số hạt mỗi loại.
2.3. Điền từ hoặc cụm từ thích hợp vào chỗ trống:
a. …………………….và………………. có điện tích như nhau, chỉ khác dấu.
b. …………………..và………………có cùng khối lượng, còn………có khối lượng rất bé, không đáng kể.
c. Những nguyên tử cùng loại có cùng số…………………………….trong hạt nhân.
d. Trong nguyên tử ………………….luôn chuyển động rất nhanh và sắp xếp thành từng lớp.
e…….. là hạt vô cùng nhỏ và trung hòa về điện. từ……tạo ra mọi chất. Nguyên tử hồm…….mang điện tích dương và vỏ tạo bởi………….
2.4. Vì sao nói khối lượng của hạt nhân là khối lượng của nguyên tử ?
2.5.a. Nguyên tử tạo thành từ ba loại hạt nhỏ hơn nữa ( gọi là hạt dưới nguyên tử), đó là những hạt nào ?
b. Cho biết tên, kí hiệu và điện tích của những hạt mang điện.
c. Những nguyên tử cùng loại có cùng số hạt nào trong hạt nhân.
BÀI 3. NGUYÊN TỐ HÓA HỌC
3.1 Hãy viết tên và kí hiệu của 10 nguyên tố hóa học có số proton từ 1 đến 10, từ 11-20
3.2 . Hãy dùng chữ số và kí hiệu hóa học để diễn đạt các ý sau:
a. Chín nguyên tử Magie. d. năm nguyên tử Oxi
b. sáu nguyên tử Clo. e.Bảy nguyên từ Hidro
c. tám nguyên tử neon f . một nguyên tử Kali
3.3. Tính khối lượng bằng đơn vị cacbon lần lượt : 7K, 12 Si và 15 P
3.4. Hai nguyên tử magie nặng bằng mấy nguyên tử oxi?
3.5. Biết rằng bốn nguyên tử Magie nặng bằng ba nguyên tố X. Hãy viết tên và kí hiệu hóa học của nguyên tố X.
3.6. Biết nguyên tử X nặng gấp 2,5 lần nguyên tử oxi. Tính nguyên tử khối của X và cho biết X thuộc nguyên tố nào? Viết KHHH của nguyên tố đó.
3.7. Nguyên tử Y nặng gấp hai lần nguyên tử nitơ . Tính nguyên tử khối của Y và cho biết Y thuộc nguyên tố nào . Cho biết tên, kí hiệu của nguyên tố đó ?
3.8. Hãy dùng chữ số và KHHH để diễn đạt các ý sau: năm nguyên tử nhôm, ba nguyên tử sắt, hai nguyên tử lưu huỳnh, bốn nguyên tử kẽm.
3.9 Các câu sau đúng hay sai?
a) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số nơtron trong hạt nhân.
b) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số protron trong hạt nhân.
c) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số proton và nơtron trong hạt nhân.
d) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số nơtron, proton, electron trong nguyên tử.
3.11. Nguyên tử X có tổng các hạt là 34, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt.
a. Hãy xác định số proton, số nơtron và số electron trong nguyên tử X.
b. Cho biết tên, KHHH và nguyên tử khối của nguyên tố X.
3.12 Hãy so sánh xem nguyên tử Oxi nặng hay nhẹ hơn , bằng bao nhiêu lần so với :
a. Nguyên tử cacbon
b. Nguyên tử lưu huỳnh
c. Nguyên tử đồng
BÀI 6. ĐƠN CHẤT, HỢP CHẤT VÀ PHÂN TỬ
6.1. Điền từ hoặc cụm từ thích hợp vào chỗ trống:
a.Khí hiddro , khí oxi và khí Clo là những……….. , đều tạo nên từ một………….
b.Nước, muối ăn natriclo rua; axit clo hidric là những…………….. đều tạo nên từ hai…………………
Trong thành phần hóa học của nước và axit clohidric đều có chung một………………………………..; còn của muối và axit clo hidric lại có chung một………………………
6.2 . a.Khi hòa tan đường vào nước, vì sao không nhìn thấy đường nữa ?
b. Hỗn hợp nước đườngbgồm mấy loại phân tử ?
6.3. Các câu sau đúng hay sai:
a) Chất được chia làm 2 loại là đơn chất và hợp chất.
b) Đơn chất là những chất được tạo nên từ một chất.
c) Hợp chất là những chất được tạo nên từ hai chất trở lên.
d) Đơn chất được chia thành kim loại và phi kim.
e) Nước cất là một hợp chất vì nước cất có nhiệt độ sôi cố định là 100OC.
g) Từ một nguyên tố có thể tạo nên 2,3... dạng đơn chất.
6.4 a) Đơn chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học?
A. Từ 2 nguyên tố B. Từ 3 nguyên tố
C. Từ 4 nguyên tố trở lên D. Từ 1 nguyên tố
b) Hợp chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học?
A. Chỉ từ 1 nguyên tố B. Chỉ từ 2 nguyên tố
C. Chỉ từ 3 nguyên tố D. Từ 2 nguyên tố trở lên
6.5. Hãy chỉ ra chất nào là đơn chất, là hợp chất trong số các chất dưới đây:
a. Khí lưu huỳnh đioxit do 2 nguyên tố là lưu huỳnh và oxi tạo nên.
b. Khí hiđro do nguyên tố hiđro tạo nên.
c. Axit sunfuric do 3 nguyên tố là hiđro, lưu huỳnh và oxi tạo nên.
d. Khí ozon có phân tử gồm 3 O liên kết tạo nên.
e.Chất natri cacbonat có phân tử gồm 3H, 1P và 4O liên kết với nhau.
f. Đường có phân tử gồm 12c, 22H và 11 O liên kết với nhau.
6.7. Tính phân tử khối của các chất trong bài 6.5
6.8 Tính PTK của các chất sau: O3, H3PO4, Al2(SO4)3, FeSO4,7H2O, Ba(HCO3)2, Mg(H2PO4)2.
6.9. Phân tử một hợp chất gồm nguyên tử nguyên tố X liên kết với bốn nguyên tử H và nặng bằng nguyên tử O.
a. Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố X.
b. Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.
6.10. Phân tử một hợp chất gồm nguyên tử nguyên tố Y liên kết với hai nguyên tử O. Nguyên tố oxi chiếm 50% về khối lượng của hợp chất.
a. Tính nguyên tử khối , cho biết tên và kí hiệu hóa học của nguyên tố Y.
b. Tính phân tử khối của hợp chất. Phân tử hợp chất nặng bừng nguyên tử nguyên tố nào? Xác định nguyên tố đó.
6.11. Hãy so sánh phân tử kí oxi nặng hay nhẹ hơn, bằng bao nhiêu lần so với phân tử nước, phân tử muối ăn và phân tử khí metan.
BÀI 9. CÔNG THỨC HÓA HỌC
9.1. Điền từ hoặc cụm từ thích hợp vào chỗ trống:
Công thức hóa học dùng để biểu diễn……………………, gồm ………….. và …………………ghi ở chân. Công thức hóa học của ……………….chỉ gồm một………………, còn của…………….gồm từ hai……. trở lên
9.2. Viết CTHH và tính PTK của các hợp chất sau:
a. Canxi nitrat, biết trong phân tử có 1Ca, 2N, 6O.
b. Nhôm hiđroxit, biết trong phân tử có 1Al, 3O, 3H.
c. Kali photphat, biết trong phân tử có 3K, 1P, 4O.
d. Sắt (III) sunfat, biết trong phân tử có 2Fe, 3S, 12O.
e. Mangan đi oxit biết trong phân tử có 1Mn và 2 O.
f. Bari clorrua, biết trong phân tử có 1 Ba và 2 Cl.
g. Bạc nitrat, biết trong phân tử có 1 Ag, 1N, và 30.
h. Nhôm phốt phát, biết trong phân tử có 1 Al, 1 P và 4 O
9.3. Biết CTHH của một số chất như sau:
a. Natri sunfat Na2SO4 c. Axit sunfuhidric H2S e. Liti hiddro xit LiOH
b. Nhôm clorua AlCl3 d. Nhôm oxit Al2O3 f. Magie cacbonat MgCO3
Hãy nêu ý nghĩa của các CTHH trên.
9.4. Một hợp chất có phân tử gồm 2 nguyên tử nguyên tố X liên kết với 1 nguyên tử O và nặng hơn phân tử hiddro 31 lần.
a. Tính phân tử khối của hợp chất
b. Tính nguyên tử khối của X, cho biết tên và kí hiệu hóa học của nguyên tố.
BÀI 10. HÓA TRỊ
10.1. Điền từ hoặc cụm từ thích hợp vào chỗ trống:
Hóa trị là con số biểu thị………………………………………….của …………………..nguyên tố này ( hay………………) với……………….nguyên tố khác. Hóa trị của một ………………….( hay……………….) được xác định theo ……………của H chọn làm đơn vị và……………..của O là hai đơn vị.
10.2. Tính hóa trị của mỗi nguyên tố trong các hợp chất sau:
a. Al2O3; SO2 b. CH4; NH3
10.3. Lập CTHH của hợp chất tạo bởi:
a. Silic (hóa trị IV) và oxi
b. Nhôm (hóa trị III) và nhóm OH (hóa trị I)
10.4. Viết CTHH của những hợp chất tạo bởi các nguyên tố: K, Zn, Ca với:
a. Nhóm hiđroxit (OH)
b. Nhóm cacbonat (CO3)
c. Nhóm photphat (PO4)
10.5. Biết Cr (crom) hóa trị III, hãy chọn CTHH đúng trong số các công thức cho sau đây:
A. CrSO4 B. Cr2SO4 C. Cr(SO4)2 D. Cr2(SO4)3
10.6 Tính hóa trị của mỗi nguyên tố trong hợp chất, biết nhóm NO3 có hóa trị I và nhóm CO3 có hóa trị II
Của các chất sau: Na(NO3)2, Fe (NO3)3, CuCO3, Li2CO3
LUYỆN TẬP CHƯƠNG 1
11.1. Phân tử của một hợp chất gồm nguyên tử của nguyên tố X liên kết với 3 nguyên tử oxi. Nguyên tố X chiếm 40% về khối lượng của hợp chất.
a) Tính phân tử khối của hợp chất.
b) Tính nguyên tử khối, cho biết tên và KHHH của nguyên tố X.
11.2. Khi đốt cháy một chất trong oxi thu được khí cacbonic CO2 và hơi nước H2O. Hỏi nguyên tố nào nhất thiết phải có trong thành phần của chất mang đốt?
A. Cacbon và oxi B. Hiđro và oxi
C. Cacbon và hiđro D. Cacbon, hiđro và oxi
11.3. Tính hóa trị của Mg, P, S, Fe trong các CTHH sau:
a) MgCl2 b) P2O5 c) SO3 d) Fe(OH)2
11.4. Lập CTHH và tính phân tử khối của hợp chất có phân tử gồm:
a) Natri liên kết với nhóm nitrat (NO3)
b) Nhôm liên kết với nhóm sunfat (SO4)
Cho biết công thức hóa học của hợp chất của nguyên tố X với nhóm (SO4) và hợp chất của nhóm nguyên tử Y với H như sau: X2(SO4)3; YH3. Xác định công thức của hợp chất của X và Y.
11.5. Lập công thức hóa học và tính PTK của các hợp chất có phân tử gồ Na, Cu (II) và Al lần lượt liên kết với:
a. Brom Br (I) b. Lưu huỳnh S ( II) c. Hiddro xit (OH) (I) d. photphat (PO4) (III)
11.6. Công thức hóa học của một số hợp chất của nhôm viết như sau: AlCl4; AlNO3; Al2O3; AlS; Al3 (SO4)2; Al (OH)2; Al 2(PO4)3. Công nào sai, hãy sửa lại cho đúng.
CHƯƠNG II. PHẢN ỨNG HÓA HỌC
BÀI 12. SỰ BIẾN ĐỔI CHẤT
12.1. Điền từ hoặc cụm từ thích hợp vào chỗ trống:
a. Với các………………….có thể xảy ra những biến đổi thuộc hai loại hiện tượng . Khi…………….. biến đổi mà vẫn giữ nguyên là………………. Ban đầu, sự biến đổi thuộc loại hiện tượng………………..Còn khi …………..biến đổi thành ………….khác, sự biến đổi thuộc loại hiện tương……………………
12.2. Hãy chỉ ra đâu là hiện tượng vật lý, hiện tượng hóa học trong các quá trình sau:
a. Đung nóng một ít bột NaHCO3 trong ống nghiệm, màu trắng không đổi nhưng thoát ra một chất khí có thể làm đục nước vôi trong .
b. Khi đốt đèn cồn, cồn cháy biến đổi thành khí cacbonic và hơi nước
c. Dây tóc trong bóng đèn điện nóng và sáng lên khi dòng điện đi qua
d. Đinh sắt để trong không khí bị gỉ .
e. Nước bay hơi.
f. parafin nóng chảy .
g. Khí metan cháy tạo thành khí cacbonic và hơi nước.
h. Hòa tan đường vào nước.
i. Sữa để lâu bị chua
k. Xác động vật chết bị thối rữa.
l. Amoniac bay hơi vào không khí
m. Thuốc tím ( kali pemanganat) bị phân hủy khi đun nóng.
n. Sự bay hơi của cồn.
o. Sự ngưng tụ của nước.
p. Đốt nhựa thấy có mùi khét.
q. Tán sắt thành đinh
12.3. Sản xuất vôi được tiến hành qua hai công đoạn chính . Đá vôi ( thành phần chính là canxi cacbonat ) được đập thành cục nhỏ tương đối đều nhau . Sau đó đá vôi được xếp vào lò nung nóng thì thu được vôi sống ( chất canxi oxit ) , và khí cacbon đioxit thoát ra. Giải thích cho biết ở công đoạn nào xảy ra hiện tượng vật lí , công đoạn nào xảy ra hiện tượng hóa học.
12.4 Hãy phân tích cho biết trường hợp nào xảy ra hiện tượng hóa học, trường hợp nào xảy ra hiện tượng vật lý.
a. Khi ta mở nút chai nước giải khát có ga thấy bọt sủi lên.
b. Hòa vôi sống vào nước được vôi tôi( vôi tôi là chất canxi hiddroxit, nước vôi trong là dung dịch chất này).
12.5
BÀI 13. PHẢN ỨNG HÓA HỌC
13.1 Điền từ hoặc cụm từ thích hợp vào chỗ trống:
……………………..là quá trình làm biến đổi chất này thành chất khác. Chất biến đổi trong phản ứng gọi là……………….., còn ………………mới sinh ra là…………….. Trong quá trình phản ứng…………..giảm dần,……………..tăng dần.
13.2. a) Giải thích tại sao khi để ngọn lửa đến gần là cồn (rượu etylic) đã bắt cháy.
b) Biết rằng cồn cháy được là có sự tham gia của khí oxi, tạo ra nước và khí cacbon đioxit. Viết phương trình chữ của phản ứng.
13.3. Viết phương trình chữ của phản ứng hóa học xảy ra trong các hiện tượng sau:
a) Khi bị nung ở nhiệt độ cao, canxi cacbonat bị phân hủy thành canxi oxit (vôi sống) và khí cacbon đioxit.
b) Đốt bột nhôm trong không khí, nhôm cháy sáng tạo ra chất rắn màu trắng là nhôm oxit.
c) Cho dây nhôm vào dung dịch axit sunfuric, thấy có bọt khí hiđro bay ra. Cô cạn dung dịch thì thu được muối nhôm sunfat.
13.4. Sắt để trong không khí ẩm dễ bị gỉ . Hãy giải thích vì sao ta có thể phòng chống gỉ bằng cách bôi dầu mở trên bề mặt các đồ dùng bằng sắt.
13.5. a.Giải thích tại sao khi để ngọn lửa đến gần là cồn đã bắt cháy.
b. Biết rằng cồn cháy được là có sự tham gia của khí oxi, tạo ra nước và khii cacbon ddioxxit. Viết PT chữ của phản ứng.
13.6. Nếu vô ý để giấm đổ lên nền gạch đá hoa ( trong thành phần có chứa chất canxi cacbonat) ta sẽ quan sát thấy có bọt khí sủi lên.
a. Dấu hiệu nào ở đây cho thấy phản ứng đã xảy ra.
b. Viết phương trình chữ của phản ứng biết rằng sản phẩm là các chất canxi axetat, nước và khí cacbon đi oxit
BÀI 14. ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
14.1. Khi nung canxi cacbonat CaCO3 ở nhiệt độ cao, người ta thu được canxi oxit CaO (vôi sống) và khí cacbon đioxit CO2.
a) Ghi lại phương trình chữ của phản ứng.
b) Viết công thức về khối lượng của phản ứng xảy ra.
c) Tính khối lượng khí cacbon đioxit sinh ra khi nung 3 tấn canxi cacbonat và thu được 1,68 tấn canxi oxit.
d) Nếu thu được 224 kg canxi oxit và 176 kg khí cacbon đioxit thì khối lượng canxi cacbonat tham gia phản ứng là bao nhiêu?
14.2. Khi đốt lưu huỳnh trong không khí, lưu huỳnh hóa hợp với khí oxi O2 tạo ra khí lưu huỳnh đioxit SO2.
a) Ghi lại phương trình chữ của phản ứng.
b) Viết công thức về khối lượng của phản ứng xảy ra.
c) Nếu đốt cháy 16g lưu huỳnh và khối lượng khí lưu huỳnh đioxit thu được là 32g. Hãy tính khối lượng oxi tham gia phản ứng.
14.3 . Cho 6,5 gam kẽm Zn phản ứng với 7,3 gam axit clohidric HCl thu được chất kẽm clorua là 13,6g và m gam khí hidro.
a. Ghi lại phương trình khối lượng
b.Tính khối lượng khí hidro bay lên.
14.4. Hãy giải thích:
a. Khi nung nóng cục đá vôi thì thấy khối lượng giảm đi?
b. Khi nung nóng miếng đồng trong không khí ( có khí oxi) thì thấy khối lượng tăng lên.
14.5. Đốt 3,2 gam lưu huỳnh trong không khí thu được 6,4 gam lưu huỳnh đi oxit. Tính khối lượng oxi đã tham gia phản ứng.
14.6. Đốt m gam kim loại Mg trong không khí thu được 8 gam hợp chất Magie oxit (MgO). Biết khối lượng Mg tham gia bằng 1,5 lần khối lượng oxi. ( không khí) tham gia phản ứng.
a. Viết phương trình phản ứng.
b. Tính khối lượng của Mg và oxi đã phản ứng.
14.7.Đa đolomit ( là hỗn hợp CaCO3 và MgCO3), khi nung nóng đá này tạo ra 2 oxit là canxi oxit CaO và Magie oxit MgO và thu được cacbon đi oxit CO2
Viết PTPU và phương trình khối lượng đá đôlô mit.
Nếu nung đa đolomit sau phản ứng thu được là 88 gam khi cacbon đi oxit và 104 kg hai oxitcacs loại thì phải dùng khối lượng đá đolomit là bao nhiêu g.
14.8 . Khi cho Mg tác dụng với axit clo hidric thì khối lượng của Magie clo rua MgCl2 nhỏ hơn tổng khối lượng của Mg và axit clohidric tham gia phản ứng. Điều này phù hợp với định luật bảo toàn khối lượng không ?
14.9. Hãy giải thích vì sao ?
a. Khi nung nóng miếng đồng thấy khối lượng tăng lên .
b. Khi nung nóng canxi cacbonat thấy khối lượng giảm đi
BÀI 16. PHƯƠNG TRÌNH HÓA HỌC
16.1. Chọn từ hoặc cụm từ thích hợp điền vào chổ trống: rắn, lỏng, hơi, phân tử, nguyên tử
a. Trước khi cháy chất parafin ở thể…………còn khi cháy ở thể…………..Các ………..parafin phản ứng với các……..khí oxi
b. ………………là quá trình làm biến đổi chất này thành chất khác. Chất biến đổi trong phản ứng gọi là ………….còn……… mới sinh ra là…….
Trong quá trình phản ứng…………giảm dần …………tăng dần
16.2. Chọn từ thích hợp điền vào chỗ trống: Chất, nguyên tử, nguyên tố, phân tử, chất phản ứng, phương trình hóa học, chỉ số, hệ số, sản phẩm, tỉ lệ
a. Phản ứng hóa học được biểu diễn bằng…………….trong đó ghi công thức hóa học của các………… và…….. ……..Trước mỗi công thức hóa học có thể có…………( trừ khi bằng 1 thì không ghi) để cho số…………….của mỗi ………. đều bằng nhau.
b. Từ ………….. rút ra được tỉ lệ số……….., số ……..của accs chất trong phản ứng……………………này bằng đúng ………………..trước công thức hóa học của các……………..tương ứng
16.3. Biết rằng chất natri hiđro xit NaOH tác dụng với axit sunfuric H2SO4 tạo ra chất natri sunfat Na2SO4 và nước
a. Lập phương trình phản ứng.
b. Cho biết tỉ lệ số phân tử NaOH lần lượt với số phân tử cảu ba chất khác trong phản ứng.
16.4. Lập PTHH của các phản ứng theo sơ đồ sau:
Al + HCl − → AlCl3 + H2
Fe(OH )3 + H 2 SO4 − → Fe2 ( SO4 )3 + H 2O
Al + Cl2 AlCl3
Na + H 2O − → NaOH + H2
16.5.Chọn hệ số và CTHH thích hợp điền vào dấu ... trong các PTHH sau:
Fe(OH ) 2 + ...HCl − → FeCl2 + 2......
Fe2 O3 + ...CO 2 Fe + 3......
...Mg + ...... ...MgO
Al + ... AgNO3 − → Al ( NO3 )3 + 3......
16.6.Cho sơ đồ của các phản ứng sau:
Al + CuCl2 − → AlCl3 + Cu
KOH + FeCl3 − → KCl + Fe(OH )3
Fe + O2 Fe3O4
Lập PTHH của mỗi phản ứng và cho biết tỉ lệ số nguyên tử, số phân tử của 2 cặp chất (tùy chọn) trong phản ứng.
16.7. Cho sơ đồ của phản ứng sau:
Al + ZnSO4 − → Al x ( SO4 )y + Zn
a) Xác định các chỉ số x, y (biết rằng x ≠ y)
Lập PTHH và cho biết tỉ lệ số nguyên tử, số phân tử của cặp chất tham gia phản ứng và cặp chất sản phẩm.
16.8. Lập PTHH và cho biế tỉ lệ số nguyên tử, số phân tử của các trong mỗi phản ứng:
a. Cr + O2 Cr2O3
b. Fe + Br2 FeBr3
c. KClO3 KCl + O2
d. NaNO3 NaNO2 + O2
e. BaCl2 + Ag NO3 − → AgCl + Ba(NO3)2
f. CxHy + O2 − → CO2 + H2O
h. CnH2n + O2 − → CO2 + H2O
g. FexOy + H2 − → H2O + Fe
16.6. Biết rằng chất natrri hiddro xit NaOH tác dụng với axit H2SO4 tạo ra chất Natri sunfat Na2SO4 và nước.
a. Lập phương trình hóa học của phản ứng.
b. Cho biết tỉ lệ số phân tử NaOH với số phân tử các chất còn lại.
16.7. Chọn hệ số và công thức phù hợp điền vào chỗ trống ( ?)
a. ? Al(OH)3 − → ? + 3 H2O
b. Fe + ? AgNO3 − → ? + 2 Ag
c. Fe(OH)y + H2SO4 − → Fex(SO4)y + H2O
ÔN TẬP CHƯƠNG II
Biết rằng khí axetilen C2H2 cháy là xảy ra phản ứng với khí oxi O2 sinh ra khí cacbon đioxit CO2 và nước.
Lập PTHH của phản ứng
Cho biết tỉ lệ giữa số phân tử axetilen lần lượt với số phân tử oxi và số phân tử nước.
Biết rằng kim loại nhôm tác dụng với axit clohiđric HCl tạo ra khí hiđro và muối nhôm clorua AlCl3
a.Lập PTHH của phản ứng.
b.Cho biết tỉ lệ giữa số nguyên tử Al lần lượt với số phân tử của 3 chất trong phản ứng.
3.Cho sơ đồ của các phản ứng sau:
a. K + O2 → K2O
b. Al + CuCl2 → AlCl3 + Cu
c. NaOH + Fe2(SO4)3 → Fe(OH)3 + Na2SO4
d. CO2 + Ca(OH)2 → CaCO3 + …………………
e. ………….+ AgNO3 → Al(NO3)3 + Ag
f. HCl + CaCO3 → CaCl2 + H2O + ………
4. Cho sơ đồ của phản ứng sau:
Fe(OH)y + H2SO4 → Fex (SO4)y + H2O
Hãy biện luận để thay x, y ( biết x khác y) bằng accs chỉ số thích hợp rồi lập phương trình há học của phản ứng.
Cho biết tỉ lệ số phân tử của bốn cặp chất trong phản ứng ( tùy chọn)
5.Biết rằng kim loại nhôm tác dụng với axit sunfuric H2SO4 tạo ra khí hidro và chất nhôm sunfat Al2(SO4)3
a. Lập phương trình hóa học của phản ứng.
b.Cho biết tỉ lệ giữa số nguyên tử Al lần lượt với số phân tử của ba chất trong phản ứng.
CHƯƠNG III. MOL VÀ TÍNH TOÁN HÓA HỌC
BÀI 18. MOL
1.Hãy cho biết số nguyên tử hoặc số phân tử có trong những lượng chất sau:
a.0,2 mol nguyên tử O b. 0,5 mol phân tử Cl c. 1,25 mol nguyên tử S d.0,75 mol phân tử SO2
2. xác định khối lượng của những chất sau:
a.0,1 mol nguyên tử Zn b. 0,3 mol phân tử O2 c. 0,9 mol nguyên tử Fe d. 1,5 mol phân tử CH4
3. Hãy tìm thể tích của những lượng khí sau ở điều kiện tiêu chuẩn :
a) 0,4 mol phân tử CO2
b) Hỗn hợp khí gồm có : 0,25 mol N2 và 0,5 mol O2
c) 0,5 mol phân tử H2S
4. Hãy xác định khối lượng và thể tích khí ( đktc) của những lượng chất sau:
a. 0,05 mol phân tử O2: 0,15 mol phân tử H2; 14 mol phân tử CO2
b. Hỗn hợp khí gồm có 0,75 mol CO2; 0,25 mol N2; và 0,5 mol O2.
c. 0,02 mol của mỗi chất khí sau : CO, CO2, H2, O2.
BÀI 19. CHUYỂN ĐỔI GIỮA KHỐI LƯỢNG, THỂ TÍCH VÀ LƯỢNG CHẤT
Hãy cho biết số mol và số nguyên tử hoặc số phân tử của những lượng chất sau :
10,8 gam nhôm
16,0 gam khí lưu huỳnh đioxit SO2
28,4 gam điphotphopentaoxit P2O5
Hãy cho biết số mol và khối lượng của những thể tích khí sau ở điều kiện tiêu chuẩn :
5,6 lít khí cacbon đioxit CO2
10,08 lít khí amoniac NH3
16,8 lít khí nitơ đioxit NO2
3. Hãy tìm khối lượng của những đơn chất và hợp chất sau: CO2, H2O, N2, O2, H2, NaCl để cùng số phân tử bằng nhau là 0,6 .1023.
4. Phải lấy bao nhiêu gam của mỗi chất khí sau để chúng cùng có thể tích khí là 5,6 lít khí ở đktc:
CO2 b. CH4 c. O2 d.N2 e. Cl2
BÀI 20. TỈ KHỐI CUẢ CHẤT KHÍ
1. Có những khí sau: C4H10, CO2, H2S, NH3. Hãy cho biết:
Những khí nào nặng hay nhẹ hơn không khí và nặng hay nhẹ hơn bao nhiêu lần?
Những khí nào nặng hay nhẹ hơn khí C3H6 và nặng hay nhẹ hơn bao nhiêu lần?
Tìm khối lượng mol của các chất khí có tỉ khối đối với:
Khí hiđro là: 16 ; 13 ; 32
Khí nitơ là: 2,536 ; 1,3036 ; 1,5714
3.Có những khí sau: N2, O2, SO2, H2S, CH4. Hãy cho biết:
a. Những khí nào nặng hay nhẹ hơn không khí bao nhiêu lần ?
b.Những khí nào nặng hay nhẹ hơn khí hidro bao nhiêu lần ?
c. Khí SO2 nặng hay nhẹ hơn khí O2 là bao nhiêu lần ?
d. Khí nào nặng nhất ? Khí nào nhẹ nhất ?
4. Hỗn hợp X gồm 0,15 mol CO2 và 0,1 mol O2. Tính tỉ khối của X so với Oxi, so với không khí .
5. Hỗn hợp khí A gồm Cl2 và O2 có tỉ khối đối với H2 là 23,8.
a. Tính thành phần phần trăm về thể tích.
b. Tính khối lượng của mỗi khí có trong 5,95 gam hỗn hợp A trên.
BÀI 21. TÍNH THEO CÔNG THỨC HÓA HỌC
Tính thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất sau :
Oxit sắt từ Fe3O4 c. Natri oxit Na2O
Natri sunfat Na2SO4 d. Canxi hidro xit Ca(OH)2
Tìm công thức hóa học của hợp chất có thành phần các nguyên tố như sau : 55,189% K; 14,623 % P và còn lại là oxi . Biết 0,05 mol hợp chất có khối lượng là 10,6 gam .
Tìm công thức hóa học của hợp chất khí A . Biết tỉ khối của khí A đối với oxi là 1,375 và thành phần phần trăm các nguyên tố trong hợp chất là : 81,8182% C, phần còn lại là hiđro .
Lập CTHH của một hợp chất biết :
- Phân tử khối của hợp chất là 160 đvC .
- Trong hợp chất có 70% khối lượng là sắt và 30% khối lượng là oxi
5. Hãy tìm công thức hóa học của khí A, biết rằng:
- Khí A nặng hơn khí Hidro là 8,5 lần.
- Thành phần % theo khối lượng các nguyên tố trong chất khí A là : 82,35 % N còn lại là H.
6. Phân đạm Ure có công thức hóa học là CO( NH2)2 . Hãy xác định :
a. Tính khối lượng mol phân tử của U rê.
b. Thành phần % theo khối lượng của mỗi nguyên tố có trong mỗi hợp chất trên.
BÀI 22. TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC
1.Nung 50 gam đá vôi CaCO3 thu được vôi sống CaO và khí cacbonic CO2
Viết PTHH
Tính khối lượng vôi sống sinh ra.
Tính thể tích khí CO2 ( ĐKTC)
2.Khi cho 8g O2 tác dụng với Na thu được natri oxit Na2O.
Viết PTHH
Tính khối lượng Na tham gia
Tính khối lượng Na2O sinh ra,
3.Cho 2,7 gam Al tác dụng với axit Clo hidric HCl thu được nhôm clorua AlCl3 và khí hidro.
a.Tính thể tích khí hidro ( đktc)
b.. Khối lượng HCl tham gia.
c. Khối lượng muối sinh ra.
4. Hãy tìm thể tích khí oxi đủ để đốt cháy hết 6,72 lít khí B. Biết rằng:
- Khí A có tỉ khối đối với không khí là 0,552.
- Thành phần theo khối lượng của Khí A là 75% C và 25% H.( các khí đo ở ĐKTC)
5. Trong phòng thí nghiệm người ta có thể điều chế khí oxi bằng cách đun nóng Kalipemanganat.
KMnO4 -- K2MnO4 + MnO2 + O2
Muốn điều chế 4,48 lit oxi ( đktc) cần bao nhiêu gam KMnO4.
Nếu dùng 0,1 mol KMnO4 thì thu được bao nhiêu gam khí oxi sinh ra,
Khi nung 790 gam KMnO4 thi thu được khối lượng các chất sau phản ứng là bao nhiêu.
6.Khi cho Hodro dư đi qua đồng II oxit nóng màu đen, người ta thu được 0,32 gam kim loại đồng màu đỏ và hơi nước ngưng tụ.
a.Viết PTHH.
b.Tính lượng đồng II oxit tham gia phản ứng.
c. Tính thể tích khí hidro ở đktc đã tham gia phản ứng.
d.Tính lượng nước ngưng tụ sau phản ứng.
7. Đốt nóng 1,35 gam bột nhôm trong khí Clo, người ta thu được 6,675 gam nhôm Clorua. Em hãy cho biết:
a. Công thức hóa học đơn gian của nhôm clorua, giả sử rằng ta chưa biết hóa trị của nhôm và Clo.
b. Phương trình hóa học của nhôm tác dụng với clo.
c. Tính thể tích clo ( đktc) đã tham gia phản ứng với nhôm.
8. Đốt khí hidro trong khí oxi người ta nhận thấy cứ 2 thể tích khí hido hợp với 1 thể tích khí oxi tạo thành nước.
a. Hãy tìm công thức hóa học đơn gian của nước.
b.Viết PTHH xảy ra khi đốt hidro và oxi.
c. Sau phản ứng người ta thu được 1,8g nước. Hãy tìm thể tích các khí H2 và O2 tham gia phản ứng ở đktc
ÔN TẬP CHƯƠNG III
Một hợp chất có công thức hóa học là Na2CO3 . Hãy tính thành phần phần trăm ( theo khối lượng ) của các nguyên tố có trong hợp chất .
Tìm công thức hóa học của hợp chất khí A . Biết tỉ khối của A đối với khí amoniac NH3 là 2 và thành phần phần trăm các nguyên tố trong hợp chất là 5,882% H , phần còn lại là lưu huỳnh.
Khí axetilen C2H2 cháy trong oxi sinh ra khí cacbon đioxit CO2 và nước H2O.
Lập phương trình hóa học của phản ứng .
Tính thể tích khí oxi cần dùng để đốt cháy hoàn toàn 4 lít khí axetilen. Các thể tích khí đo cùng điều kiện nhiệt độ và áp suất.
4.Cho 21 gam hỗn hợp X gồm Na và K2O vào nước lấy dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít H2( đktc). Tính thành phần % về khối lượng của mỗi chất trong X.
5.Đốt cháy hoàn toàn hỗn hợp X gồm CH4 và H2, thu được 2,24 lít CO2(đktc) và 6,3 gam H2O
a. Viết PTHH của các phản ứng đã xảy ra.
b. Tính khối lượng mỗi chất trong hỗn hợp. ( Lưu ý 2 mol CH4 + số mol H2 = Mol H2O)
c. Tính tỉ khối của X đối với H2
6. Đốt cháy 18 gam cacbon C trong không khí sinh ra khí cacbon đi oxit ( CO2)
a. Viết PTHH
b. Tính thế tích khí cacbon đi oxit sinh ra ở đk phòng .
c. Tính thể tích không khí cần dùng biết oxi chiếm 1/5 thể tích không khí.
HẾT HKI
ÔN TẬP HỌC KÌ I
Dạng bài tập 1: Phân loại đơn chất, hợp chất
Phân loại các chất sau theo đơn chất, hợp chất: khí hidro, nước , đường saccarozo (C12H22O11 ), nhôm oxit (Al2O3), đá vôi (CaCO3), khí cacbonic (CO2), muối ăn (NaCl), dây đồng, bột lưu huỳnh, khí Clo.
Dạng bài tập 2: Hóa trị
Bài tập mẫu: a) Tính hóa trị của nguyên tố N trong hợp chất N2O5
Giải: Gọi a là hóa trị của nguyên tố N trong hợp chất N2O5 (a>O)
Ta có: a II
N2O5 a*2 = 5*II a = a = V Vậy trong CT hợp chất N2O5 thì N(V)
Bài tập mẫu: b) Tính hóa trị của nguyên tố S trong hợp chất SO2
Giải: Gọi a là hóa trị của nguyên tố S trong hợp chất SO2 (a>O)
Ta có: a II
SO2 a*1 = 2*II a = a = IV Vậy trong CT hợp chất SO2 thì S(IV)
Bài tập mẫu: c) Tính hóa trị của nhóm PO4 trong hợp chất Ca3(PO4)2 , biết nguyên tố Ca(II)
Giải: Gọi b là hóa trị của nhóm PO4 trong hợp chất Ca3(PO4)2 (b>O)
Ta có: II b
Ca3(PO4)2 3*II = 2*b b = b = III Vậy trong CT hợp chất Ca3(PO4)2 thì PO4 (III
Câu1: Xác định nhanh hóa trị của mỗi nguyên tố hoặc nhóm nguyên tử trong các hợp chất sau đây: NO ; NO2 ; N2O3 ; N2O5; NH3; HCl; H2SO4; H3PO4; Ba(OH)2; Na2SO4; NaNO3; K2CO3 ; K3PO4 ; Ca(HCO3)2 Na2HPO4 ; Al(HSO4)3 ; Mg(H2PO4)2
Câu 2: Lập nhanh CTHH của những hợp chất sau tao bởi:
P ( III ) và O; N ( III )và H; Fe (II) và O; Cu (II) và OH; Ca và NO3; Ag và SO4, Ba và PO4; Fe (III) và SO4, Al và SO4; NH4 (I) và NO3
Dạng bài tập 3: Định luật bảo toàn khối lượng
Câu 1: Có thể thu được kim loại sắt bằng cách cho khí cacbon monoxit CO tác dụng với chất sắt (III) oxit . Khối lượng của kim loại sắt thu được là bao nhiêu khi cho 16,8 kg CO tác dụng hết với 32 kg sắt (III) oxit thì có 26,4 kg CO2 sinh ra.
Câu 2: Khi nung nóng quặng đồng malachite, chất này bị phân hủy thành đồng II oxit CuO, hơi nước và khí cacbonic.
Tính khối lượng của khí cacbonic sinh ra nếu khối lượng malachite mang nung là 2,22g, thu được 1,60 g đồng II oxit và 0,18 g nước.
Nếu thu được 6 g đồng II oxit; 0,9 g nước và 2,2 g khí cacsbonic thì khối lượng quặng đem nung là bao nhiêu?
Dạng bài tập 4: Phương trình hóa học
Chọn hệ số thích hợp để cân bằng các phản ứng sau:
1/ Al + O2 Al2O3
2/ K + 02 K2O
3/ Al(0H)3 Al203 + H20
4/ Al203 + HCl AlCl3 + H20
5/ Al + HCl AlCl3 + H2
6/ Fe0 + HCl FeCl2 + H20
7/ Fe203 + H2S04 Fe2(S04)3 + H20
8/ Na0H + H2S04 Na2S04 + H20
9/ Ca(0H)2 + FeCl3 CaCl2 + Fe(0H)3
10/ BaCl2 + H2S04 BaS04 + HCl
Dạng bài tập 5: Chuyển đổi giữa khối lượng, thể tích và lượng chất
Câu 1: Hãy tính :
Số mol CO2 có trong 11g khí CO2 (đktc)
Thể tích (đktc) của 9.1023 phân tử khí H2
Câu 2: Hãy cho biết 67,2 lít khí oxi (đktc)
Có bao nhiêu mol oxi?
Có bao nhiêu phân tử khí oxi?
Có khối lượng bao nhiêu gam?
Cần phải lấy bao nhiêu gam khí N2 để có số phan tử gấp 4 lần số phân tử có trong 3.2 g khí oxi.
Câu 3: Một hỗn hợp gồm 1,5 mol khí O2; 2,5 mol khí N2; 1,2.1023 phân tử H2 và 6,4 g khó SO2.
Tính thể tích của hỗn hợp khí đó ở đktc.
Tính khối lượng của hỗn hợp khí trên.
Dạng bài tập 6: Tính theo công thức hóa học:
Bài tập mẫu: a) Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất NaOH
Ta có: M= 23+16+1= 40 (g)
%Na = 100% = 57,5 (%) ; %O = 100% = 4O (%) ; %H = 100% = 2,5 (%)
Bài tập mẫu: b) Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất Fe(OH)3
Ta có: M = 56+(16+1)*3 = 107 (g)
%Fe = 100% = 52,34 (%) ; %O = 100% = 44,86 (%) ; %H = 100% = 2,80 (%)
Câu 1: Tính phần trăm khối lượng của các nguyên tố trong hợp chất: NaNO3; K2CO3 , Al(OH)3, SO2, SO3, Fe2O3.
Câu 2: Xác định CTHH của hợp chất giữa nguyên tố X với O có %X = 43,67%. Biết X có hóa trị V trong hợp chất với O. (ĐS: P2O5)
Câu 3: Hợp chất B có %Al = 15,79%; %S = 28,07%, còn lại là O. Biết khối lượng mol B là 342.Viết CTHH dưới dạng Alx(SO4)y .Xác định CTHH. (ĐS: Al2(SO4)3 )
Câu 4:Một hợp chất khí X có tỉ khối đối với hidro là 8,5. Hãy xác định công thức hóa học của X biết hợp chất khí có thành phần theo khối lượng là 82,35% N và 17,65% H.(ĐS: NH3)
Câu 5: Một hợp chất X của S và O có tỉ khối đối với không khí là 2,207.
Tính MX (ĐS: 64 đvC)
Tìm công thức hóa học của hợp chất X biết nguyên tố S chiếm 50% khối lượng, còn lại là O. (ĐS: SO2)
Dạng bài tập 7: Tính toán và viết thành công thức hóa học
Bài tập mẫu: Hợp chất Crx(S04)3 có phân tử khối là 392 đvC. Tính x và ghi lại công thức hóa học?
Ta có: PTK của Crx(S04)3 = 392 Crx = 392 – 288 x = 104 : 52 = 2
Vậy CTHH của hợp chất là Cr2(S04)3
Bài tập tự giải: Tính x và ghi lại công thức hóa học của các hợp chất sau:
1) Hợp chất Fe2(S04)x có phân tử khối là 400 đvC.
2) Hợp chất Fex03 có phân tử khối là 160 đvC.
3) Hợp chất Al2(S04)x có phân tử khối là 342 đvC.
4) Hợp chất K2(S04)x có phân tử khối là 174 đvC.
5) Hợp chất Cax(P04)2 có phân tử khối là 310 đvC.
6) Hợp chất NaxS04 có phân tử khối là 142 đvC.
7) Hợp chất Zn(N03)x có phân tử khối là 189 đvC.
8) Hợp chất Cu(N03)x có phân tử khối là 188 đvC.
9) Hợp chất KxP04 có phân tử khối là 203 đvC.
10) Hợp chất Al(N03)x có phân tử khối là 213 đvC.
Dạng bài tập 8: Tính theo phương trình hóa học
Câu 1: Cho 11,2gam Fe tác dụng với dung dịch HCl .Tính:
a. Thể tích khí H2 thu được ở đktc.(ĐS:4,48 lít)
b. Khối lượng HCl phản ứng.(ĐS:14,6 g)
c. Khối lượng FeCl2 tạo thành.(ĐS:25,4 g)
Câu 2: Cho phản ứng: 4Al + 3O2 2Al2O3. Biết có 2,4.1022 nguyên tử Al phản ứng.
a. Tính thể tích khí O2 đã tham gia phản ứng ở đktc. Từ đó tính thể tích không khí cần dùng . Biết khí oxi chiếm 1/5 thể tích của không khí.( ĐS: 0,672 lít; 3,36 lít)
b. Tính khối lượng Al2O3 tạo thành.(ĐS: 2.04 g)
Câu 3: Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Phương trình hoá học của phản ứng là S + O2 SO2 . Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất ? Vì sao ?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1,5 mol nguyên tử lưu huỳnh.(ĐS: 33.6 lít)
c) Khí sunfurơ nặng hay nhẹ hơn không khí ?
Dạng 1 . Lập công thức hóa học và nêu ý nghĩa của các chất dưới đây:
Bài 1. Lập công thức của các chất sau và tính phân tử khối
Na(I) và nhóm SO4 (II); Fe (II) và O.
Một hợp chất metan gồm 1C và 4H
Hợp chất kalipemanganat gồm 1K, 1Mn và 4O
Bài 2: Nguyên tử X nặng gấp hai lần nguyên tử oxi. Hãy tính nguyên tử khối của X . Cho biết tên và kí hiệu .
Bài 3. Hãy tính nguyên tử khối của X biết: hai lần nguyên tử X nặng bằng ba lần nguyên tử oxi.
Bài 4. Nguyên tử X nặng bằng ½ nguyên tử Y và nguyên tử Y nặng bằng 1,5 nguyên tử Z. Hãy tính nguyên tử khối của X biết Z là nguyên tố oxi.
Bài 5. Một hợp chất gồm hai nguyên tử của nguyên tố X liên kết với 3 nguyên tố O và có khối lượng gấp 5 lần phân tử Oxi.
Tính phân tử khối của hợp chất.
Cho biết tên nguyên tố X, kí hiệu và công thức hóa học của hợp chất.
Bài 5. Xác định công thức hóa học của hợp chất hai nguyên tố gồ nguyên tố X và oxi. Biết X có hóa trị III và phân tử khối của hợp chất là 142.
Bài 6. Những chất khác nhau có thể có một số tính chất giống nhau được hay không ? Cho ví dụ.
Bài 7. Vì sao nói không khí và nước chanh là những hỗn hợp? Có thể thay đổi độ chua của nước chanh hay không ? Bằng cách nào ?
Bài 8. Biết lưu huỳnh không tan trong nước nhưng tan được trong rượu. Muối ăn tan được trong nước nhưng không tan được trong rượu. Hãy nêu hai phương pháp tách riêng muối ăn ra khỏi hỗn hợp bột lưu huỳnh và muối ăn?
Dạng 2. Đơn chất, hợp chất, tính phân tử khối
Bài 1: Phân loại đơn chất, hợp chất và tính phân tử khối của các chất sau:
Khí hidro, nước , đường saccarozo (C12H22O11 ), nhôm oxit (Al2O3), đá vôi (CaCO3), khí cacbonic (CO2), muối ăn (NaCl), kim loại đồng, bột lưu huỳnh, khí clo.
Bài 2. Tính phân tử khối của các chất sau:
NaCl b. H2SO4 c. NaOH d. FeCl3 e. Al2(SO4)3
Dạng 3: Hóa trị
Bài 1: a. Tính hóa trị của nguyên tố N, Fe lần lượt có trong các hợp chất NH3, Fe2(S04)3
b. Xác định nhanh hóa trị: H2S, SO2 ; SO3; Fe(NO3)3; Ca(HCO3)2
Bài 2: a. Lập công thức hoá học của các hợp chất tạo bởi: Mg (II)và S (II); Al(III)và SO4 (II)
b. Lập nhanh CTHH của những hợp chất tạo bởi: N (IV)và O; Fe (II) và S, Ca và PO4
Bài 3. Một loại sắt clorua chứa 34,46 % Fe và 65,54 % Cl. Xác định hóa trị của Fe trong hợp chất.
Bài 4. Cho biết CTHH của nguyên tố X với oxi là X2O và hợp chất của Y với H idro là YH2. Hãy xác định hợp chất của X với Y.
Dạng 4. Tính chất vật lý, tách chất ra khỏi hỡn hợp và sự biến đối chất
Bài 1. Hãy nêu tính chất vật lý giống và khác nhau của rượu etylic với nước.
Bài 2. Tách riêng các chất .
Hỗn hợp gồm muối ăn và bột lưu huỳnh.
Hỗn hợp sắt, bột than và lưu huỳnh.
Bài 3. Những hiện tường sau đây, hiện tượng nào là hiện tượng vật lý, hiện tượng nào là hiện tượng hóa học.?
Nước bay hơi.
Parafin nóng chảy
Khí metan cháy tạo thành khí cacbonic và hơi nước.
Sắt bị gỉ trong không khí ẩm.
Sữa để lâu bị chua
Amoniac bay hơi vào không khí
Sự ngưng tụ của nước
Giũa một dinh sắt thành mạc sắt.
Bài 4. Về mùa hè thức ăn thường bị thiu thối. Đó có phải là sự biến đổi hóa học không ? Giải thích
Dạng 4: Phương trình hóa học
Bài 1: Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của chất trong mỗi phản ứng:
1/ Na + O2 Na2O 2/ P + O2 P2O5 3/ Zn + Cl2 ZnCl2 4/ Al + S Al2S3 5/ KClO3 KCl + O2 6/ KNO3 KNO2 + O2 7/ Al(0H)3 Al203 + H20 8/ H2 + Fe2O3 Fe + H2O 9/ CO + Fe2O3 Fe + CO2 10/ H2 + CuO Cu + H2O |
11/ Al + HCl AlCl3 + H2 12/ Zn + HCl ZnCl2 + H2 13/ Al + H2S04 Al2(S04)3 + H2 14/ FeO + HCl FeCl2 + H20 15/ Na20 + H20 Na0H 16/ N205 + H20 HN03 17/ Ca(OH)2 + FeCl3 CaCl2 + Fe(OH)3 18/ CuCl2 + AgN03 Cu(N03)2 + AgCl 19/ Na0H + FeS04 Na2S04 + Fe(OH)2 20/ BaCl2 + H2S04 BaS04 + HCl |
Bài 2. Hoàn thành các PTHH sau
1./K + H2O ----> ........ + ......
2/ P2O5 + ........ ----> H3PO4
3/ Al + ........ ----> AlCl3 +......
4/ Al + O2 ----> ...............
5/ Zn + .......----> ZnCl2 + H2
6/ Fe2O3 + ......... ----> Fe + H2O
7/ Cu + AgNO3 ----> Cu(NO3)2 + ..........
8./ CxHy + O2 ----> CO2 + H2O
9. CnH2n + O2 ----> CO2 + H2O
10.CnH2n + 1 + O2 ----> CO2 + H2O
11. CnH2n + 2 + O2 ----> CO2 + H2O
Dạng 5: Bài toán áp dụng định luật bảo toàn khối lượng
Bài 1. Hãy giải thích vì sao ?
Khi nung nóng miếng đồng thấy khối lượng tăng lên.
Khi nung nóng canxi cacbonat CaCO3 thấy khối lượng giảm đi.
Bài 2. Khí metan (CH4) cháy trong khí oxi sinh ra khí cacbon ddioxxit (CO2) và hơi nước.
Viết PT chữ của phản ứng trên
Cho biết khối lượng của metan là 48 gam, khí cacbondioxxit là 132g, của nước là 108 gam. Tính khối lượng của oxi cần tham gia.
Bài 3 .Biết rằng kim loại nhôm tác dụng với axit sunfuric tạo thành muối sunfat và khí hidro.
Lập phương trình chữ của phản ứng.
Lập công thức về khối lượng của các chất trong phản ứng xảy ra.
Cho 5,4 gam nhôm tác dụng với 19,6 gam axit sunfuric tạo ra 23,6 gam nhôm sunfat. Khối lượng khí Hidro thoát ra là bao nhiêu ?
Bài 4. Thành phần chính của khí đất đèn là canxicacbua. Khi cho đất đèn hợp nước theo phản ứng sau:
Canxicacbua + nước canxi hidroxit + khí axetilen
Biết rằng khi cho 80 gam đất đèn hợp vói 36 kg nước thu ược 74 kg canxihiroxit và 26 kg khí axetilen
Viết công thức về khối lượng của phản ứng
Tính tỉ lệ % về khối lượng canxi cacbua có trong khí đất đèn
Dạng 5: Chuyển đổi giữa khối lượng, thể tích và lượng chất. Tỷ khối
Bài 1. a. Tính số mol của : 14g Fe, 20g Ca, 25g CaCO3, 4g NaOH, 1,5.1023phân tử H2O
b. Tính khối lượng của: 0,25mol ZnSO4, 0,2 mol AlCl3, 0,3 mol Cu; 0,35mol Fe2(SO4)3.
c. Tính thể tích của các chất khí ở đktc: 0,2mol CO2; 0,15mol Cl2; 0,3mol SO2; 0,5mol CH4.
Bài 2. 1. Tính khối lượng của hỗn hợp gồm:
a) 3 mol CO2 và 2 mol CO b) 2,24 lít SO2 và 1,12 lit O2
2. Tính thể tích ở đktc của hỗn hợp gồm:
a) 4,4 gam CO2 và 0,4 gam H2 b) 6,0. 10 23 phân tử NH3 và 3,0. 10 23 phân tử O2.
Bài 3. Tính khối lượng mol của các chất khí có tỉ khối so với khí hiđro là:16; 8; 14; 35,5; 22
Bài 4. Cho tỉ khối của khí A đối với khí B là 2,125 và tỉ khối của B đối với oxi là 0,5. Hãy tính khối lượng mol của khí A?
Bài 5. Tính số mol phân tử CO2 cần lấy để có 1,5.1023 phân tử CO2. Phải lấy bao nhiêu lít CO2 ở để có số phân tử CO2 trên ở điều kiện tiêu chuẩn.
Bài 6. Các khí CO, NH3, H2S nặng hay nhẹ hơn không khí bao nhiêu lần ?
Bài 7. Một hỗn hợp khí X gồm 0,25 mol khí SO2, 0,2 mol khí CO2, 0,75 mol khí N2 và 0,3 mol khí H2
Tính thể tích của hỗn hợp khí X ( đktc)
Tính khối lượng của hỗn hợp X.
Dạng 6: Tính theo công thức hóa học
Bài 1: Tính phần trăm khối lượng của các nguyên tố trong hợp chất: NaNO3; K2CO3 , Al(OH)3, SO2, SO3, Fe2O3.
Bài 2: Một hợp chất khí X có tỉ khối đối với hidro là 8,5. Hãy xác định công thức hóa học của X biết hợp chất khí có thành phần theo khối lượng là 82,35% N và 17,65% H.
Bài 3: Hợp chất B có %Al = 15,79%; %S = 28,07%, còn lại là O. Biết khối lượng mol B là 342.Viết CTHH dưới dạng Alx(SO4)y
Bài 4. Phân tử của một hợp chất có 30% nguyên tố Oxi về khối lượng, còn lại là nguyên tố sắt. Phân tử khối của hợp chất là 160 gam/mol. Cho biết phân tử của hợp chất có bao nhiêu nguyên tử của mỗi nguyên tố.
Bài 5. Một hợp chất có 5,88 % H về khối lượng, còn lại là lưu huỳnh. Xác định coog thức hóa học đơn giản của hợp chất.
Bài 6. Một hợp chất X tạo bới 2 nguyên tố P và O, trong đó oxy chiếm 43,64 % về khối lượng. Hãy xác định CTHH của oxit. Biết tỉ khối của hợp chất với oxi là 3,44.
Dạng 7: Tính theo phương trình hóa học
Bài 1. Sắt tác dụng với axit clohiđric: Fe + 2HCl FeCl2 + H2
Thấy sinh ra 5,6 lít khí H2 ở đktc. Hãy tính
a. Khối lượng Fe đã phản ứng.
b. Khối lượng HCl đã phản ứng.
c. Khối lượng FeCl2 tạo thành.
Bài 2: Dẫn khí hiđro H2 đi qua ống nghiệm đựng 4,8 gam đồng (II) oxit CuO, đun nóng. Sản phẩm thu được gồm kim loại đồng Cu và hơi nước H2O.
a. Viết PTHH của phản ứng.
b.Tính khối lượng kim loại đồng tạo thành.
c. Tính khối lượng nước tạo thành.
d. Tính thể tích khí hiđro (đktc) đã phản ứng.
Bài 3. Cho 13g kẽm Zn tác dụng hoàn toàn với axit clohiđric HCl tạo thành muối kẽm clorua ZnCl2 và giải phóng khí hiđro H2.
Viết PTHH của phản ứng.
Tính khối lượng HCl tham gia phản ứng và khối lượng ZnCl2 tạo thành?
Tính thể tích khí H2 tạo thành ở đktc
Bài 4. Cho 28 gam sắt tác dụng với lượng dư axit sunfuric H2SO4 tạo ra muối sắt II sun fat ( FeSO4) và khí hidro (H2)
Viết PTHH
Tính khối lượng axit tham gia phản ứng
Tính thể tích khí hidro tạo ra.
Tính khối lượng muối khan thu được sau khi cô cạn sản phẩm sau phản ứng.
Dạng 8. Tính hiệu suất phản ứng hoặc tạp chất của chất đã cho
Bài 1. Nung 10 gam CaCO3 thu đượ 4,76 gam CaO. Tính hiệu suất phản ứng nung vôi.
Bài 2. Nung 10 gam một loại đá vôi có thành phần chính là CaCO3, thu được 4,48 g CuO, biết hiệu suất phản ứng là 100%. Tính phần trăm tạp chất có trong loại đá vôi trên.
Bài 3. Cho 0,5 mol H2 tác dụng với 0,45 mol Cl2 thu được 0,6 mol HCl. Tính hiệu suất phản ứng ?
Bài 4. Nung 1kg đá vôi chứa 80% CaCO3 thu được 112 m3 ( đktc) . Tính hiệu suất phân hủy đá vôi?
Bài 5. Khi cho SO3 hợp nước thu được H2SO4. Tính lượng H2SO4 điều chế đượ khi cho 40gam SO3 hợp nước, biết hiệu suất phản ứng là 95%.
ĐỀ THAM KHẢO HỌC KÌ I
Câu 1 (2,0 điểm)
a) Hãy cho biết thế nào là đơn chất? Hợp chất?
b) Trong số các công thức hóa học sau: CO2, O2, Zn, CaCO3, công thức nào là công thức của đơn chất? Công thức nào là công thức của hợp chất?
Câu 2 (1,0 điểm): Lập công thức hóa học và tính phân tử khối của:
a) Fe (III) và O.
b) Cu (II) và PO4 (III).
Câu 3 (3,0 điểm)
a) Thế nào là phản ứng hóa học? Làm thế nào để biết có phản ứng hóa học xảy ra?
b) Hoàn thành các phương trình hóa học cho các sơ đồ sau:
Al + O2 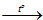 Al2O3
Al2O3
Na3PO4 + CaCl2 → Ca3(PO4)2 + NaCl
Câu 4 (2,0 điểm)
a) Viết công thức tính khối lượng chất, thể tích chất khí (đktc) theo số mol chất.
b) Hãy tính khối lượng và thể tích (đktc) của 0,25 mol khí NO2.
Câu 5 (1,0 điểm): Xác định công thức hóa học của hợp chất tạo bởi 40% S, 60% O. Khối lượng mol của hợp chất là 80 gam.
Câu 6 (1,0 điểm): Khi đốt dây sắt, sắt phản ứng cháy với oxi theo phương trình:
3Fe + 2O2 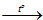 Fe3O4
Fe3O4
Tính thể tích khí O2 (đktc) cần dùng để phản ứng hoàn toàn với 16,8 gam Fe.
(Cho: Fe = 56; Cu = 64; P = 31; O = 16; N = 14; O = 16)
Mã đề 16-17
I.TRẮC NGHIỆM: (4đ)
Khoanh tròn vào câu trả lời đúng:
Câu 1: Phản ứng hóa học là quá trình làm biến đổi
A. nguyên tử này thành nguyên tử khác. B. nguyên tố này thành nguyên tố khác .
C. phân tử này thành phân tử khác . D. cả a,b.
Câu 2: Trong một phản ứng hóa học
tổng khối lượng của các nguyên tố được bảo toàn.
tổng khối lượng của các nguyên tử được bảo toàn.
tổng khối lượng của các sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
tổng khối lượng của các chất tham gia phản ứng được bảo toàn.
Câu 3: Trong một phản ứng hóa học, các chất phản ứng và sản phẩm phải chứa cùng
A. số nguyên tử trong mỗi chất . B. số nguyên tố tạo ra chất.
C. số nguyên tử của mỗi nguyên tố. D. số phân tử của mỗi chất.
Câu 4: Các quá trình kể dưới đây đâu là hiện tượng hóa học?
A. Sự bay hơi nước . B. Lưỡi cuốc bị gỉ.
C. Hòa tan đường vào nước . D. Cồn để trong lọ không kín bị bay hơi.
Câu 5: Trong một phản ứng hóa học, các chất phản ứng và sản phẩm phải chứa cùng
A. số nguyên tử trong mỗi chất . B. số nguyên tố tạo ra chất.
C. số nguyên tử của mỗi nguyên tố. D. số phân tử của mỗi chất.
Câu 6: Trong các hiện tượng sau, hiện tượng hóa học là
A. khi nấu canh cua,gạch cua nổi lên trên.
B. cồn để trong lọ không đây nắp bị cạn dần.
C.đun nước,nước sôi bốc hơi.
D. đốt cháy than để nấu nướng.
Câu 7:Cho phương trình hóa học sau: 4Na + O2 Na2O. Sản phẩm của phản ứng là
A. Na. B. O2. C. Na2O. D. Na ; O2.
Câu 8: Cho phương trình hóa học sau: 4Al + 3O2 2Al2O3. Chất tham gia phản ứng là
A. Al2O3. B. Al ; Al2O3. C. O2 ; Al2O3. D. Al ;O2.
II TỰ LUẬN: (6đ)
Câu 9: (3đ) ( Học sinh làm trực tiếp lên đề)
Cho sơ đồ phản ứng hóa học sau:
a. Al + Cl2 ----> AlCl3
b. Ba + O2 ---> BaO
c. Na + H2O ---> NaOH + H2
1. Hãy cân bằng các phản ứng hóa học trên?
2. Cho biết tỉ lệ số nguyên tử, số phân tử giữa các chất trong phản ứng c? Tỉ lệ đó có ý nghĩa gì?
Câu 3: ( 3đ ) Cho 65g kim loại Kẽm tác dụng với Axit Clohidric ( HCl) thu được 136g muối kẽm Clorua ( ZnCl2 ) và 2g khí hidro (H2 ).
a. Lập phương trình hóa học của phản ứng.
b. Cho biết tỉ lệ số nguyên tử ,số phân tử giữa các chất trong phản ứng
c. Viết công thức về khối lượng của các chất có trong phương trình trên.
d. Tính khối lượng axit clohidric đã dùng.
Mã đề 17-18
ĐỀ:
I. TRẮC NGHIỆM (4 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng
Câu 1: Thành phần cấu tạo của nguyên tử gồm các loại hạt là
A. proton, nơtron. B. proton, electron.
C. proton, nơtron, electron. D. nơtron, electron.
Câu 2: Dãy chất nào sau đây chỉ gồm công thức hóa học của các hợp chất
A. CaCO3, NaOH, Fe. B. FeCO3, NaCl, H2SO4 .
C. NaCl, H2O, H2. D. HCl, NaCl, O2.
Câu 3: Hóa trị của lưu huỳnh trong công thức SO2 là
A. II. B. VI. C. III. D. IV.
Câu 4: Phương trình phản ứng hóa học được viết đúng là
A. 4H + O2 2H2O. B. 4H + 2O 2H2O.
C. 2H2 + O2 2H2O. D. 2H + O H2O.
Câu 5: Khối lượng của 0,1 mol khí CO2 là
A. 3,3 g. B. 4,4 g. C. 2,2 g. D. 6,6 g.
Câu 6: Chất khí nặng hơn không khí là :
A. CO2. B.H2. C. CH4. D. N2
Câu 7: Cho sơ đồ phản ứng:
Al + HCl ---> AlCl3 + H2
Hệ số cân bằng của PTHH trên lần lượt là
A. 6:4:2:3. B. 2:6:2:2.
C. 2:6:2:4. D. 2:6:2:3.
Câu 8: Hiện tượng nào sau đây là hiện tượng hóa học
A. sự bay hơi nước. B. lưỡi cuốc bị gỉ.
C. hòa tan đường vào nước. D. cồn để trong lọ không kín bị bay hơi
II.TỰ LUẬN (6 điểm)
Câu 9 (1đ) Viết biểu thức tổng quát của định luật bảo toàn khối lượng.
Câu 10 (2đ).Lập phương trình hóa học cho các sơ đồ sau?
a) Al + HCl ---- > AlCl3 + H2.
b) Al(OH)3 ---- > Al2O3 + H2O
c) Na + H2O ---- > NaOH + H2
d) Fe + HCl ---- > FeCl2 + H2
Câu 11 (3,0 đ)
Tìm số mol các chất sau :
a. 32g O2.
b. 17,4g K2SO4.
c. 5,6 lít khí CO2 (đktc)
Cho: H = 1; C = 12 ; O = 16 ; S = 32; K = 39.
Đề
I.PHẦN TRẮC NGHIỆM KHÁCH QUAN:( 4.0 điểm). Chọn câu trả lời đúng nhất trong các câu hỏi sau:
Câu 1. Ở trạng thái bình thường, nguyên tử trung hòa về điện vì:
A.số nơ tron bằng số proton B. số proton bằng số electron
C.có cùng số proton D. số nơ tron bằng số electron.
Câu 2. Ở cùng điều kiện về nhiệt độ và áp suất, một mol bất kì chất khí nào cũng có thể tích:
A.bằng nhau B. 22 lít C. 22,4 lít D.24 lít
Câu 3. Đốt cháy hoàn toàn 12,8 gam đồng ( Cu) trong bình chứa oxi thu được 16 gam đồng (II) oxit (CuO). Khối lượng của oxi tham gia phản ứng là :
A.6,4 gam B. 4,8 gam C. 3,2 gam D. 28,8 gam
Câu 4. Cho công thức hóa học của một số chất sau: O2 ; FeCl2 ; Al2O3 ; Cu ; H2O ; N2. Số đơn chất và hợp chất là:
1 đơn chất và 5 hợp chất C. 2 đơn chất và 4 hợp chất
3 đơn chất và 3 hợp chất D. 4 đơn chất và 2 hợp chất
Câu 5. Công thức hóa học hợp chất của nguyên tố X với nhóm (SO4 ) có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với Hi đro là H3Y. Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:
A.XY2 B.XY3 C.XY D. X3Y2
Câu 6. Công thức của hợp chất Fe và O nào sau đúng theo quy tắc hóa trị, biết Fe có hóa trị III:
A.FeO B. Fe3O2 C. Fe2O3 D . Fe3O4
Câu 7. Một bình chứa hỗn hợp khí X gồm 1,12 lit khí oxi và 2,24 lít khí cacbon đioxit ( CO2) ở điều kiện tiêu chuẩn. Tổng số mol các khí trong hỗn hợp X là:
A. 0,25 B.0,5 C. 0,20 D.0,15
Câu 8. Những hiện tượng sau đây, hiện tượng nào là hiện tượng vật lý, hiện tượng nào là hiện tượng hóa học ?
A. Sự ngưng tụ của nước B. Sắt bị gỉ trọng không khí ẩm.
C. Nhôm nung nóng, nóng chảy để đúc xoong, nồi, chén,…
D. Đốt cháy khí metan trong không khí tạo thành khí cacbonic và hơi nước
Hiện tượng vật lý là :…………………………, Hiện tượng hóa học là :……………………………
II. PHẦN TỰ LUẬN (6.0 điểm)
Câu 1. (3,0 điểm). Lập phương trình hóa học và cho biết số nguyên tử (số phân tử ) của các chất trong mỗi phản ứng hóa học sau:
a. Na + O2 Na2O
b. KClO3 KCl + O2
c. CnH2n + 2 + O2 CO2 + H2O
Câu 2. (2,0 điểm). Cho 2,7 gam nhôm (Al) tác dụng hoàn toàn với axitclo hidric (HCl) tạo thành muối nhôm clorua ( AlCl3) và khí hiđro (H2) thoát ra.
a.Viết PTHH xảy ra.
b.Tính khối lượng axit clohiđric tham gia .
c.Tính thể tích khí hiđro thoát ra ( ở điều kiện tiêu chuẩn).
Câu 3. (1.0 điểm ). Xác định công thức hóa học của hợp chất hai nguyên tố X và Oxi. Biết X có hóa trị III và tỉ khối của hợp chất so với khí hiđro là 51.
CHƯƠNG IV: OXI-KHÔNG KHÍ
BÀI 1. TÍNH CHẤT CỦA OXI
1. Viết phương trình hóa học của phản ứng xảy ra khi cho các chất sau : C, Mg , H2 , Zn , C2H6 , FeS , C3H8O lần lượt tác dụng với oxi .
2. Đốt cháy hoàn toàn 5,4 gam nhôm trong bình chứa khí oxi .
a) Tính thể tích khí oxi đã tham gia phản ứng (đktc )?
b) Tính khối lượng chất tạo thành sau phản ứng ?
3. Tính thể tích oxi ( đktc ) cần dùng để đốt cháy hết một hỗn hợp gồm 3 gam cacbon và 3,1 gam photpho
4. Đốt cháy 2,4 gam magie trong bình chứa 3,36 lít khí oxi (đktc )
a) Chất nào còn thừa sau phản ứng và thừa khối lượng là bao nhiêu ?
b) Tính khối lượng và số phân tử của chất thu được sau phản ứng ?
BÀI 2. SỰ OXI HÓA-PHẢN ỨNG HÓA HỢP
1. Hoàn thành phương trình hóa học theo sơ đồ sau và cho biết phản ứng nào có xảy ra sự oxi hóa ? Phản ứng nào là phản ứng hóa hợp ? Vì sao ?
a) K2O + H2O --> KOH
b) C2H4 + O2 --> CO2 + H2O
c) Al + S --> Al2S3
d) FeS2 + O2 --> Fe2O3 + SO2
2. Đốt cháy 3,1 gam photpho trong bình chứa 4,8 gam khí oxi .
a) Chất nào còn thừa sau phản ứng và thừa khối lượng là bao nhiêu ?
b) Tính khối lượng sản phẩm ?
3. Đốt cháy hoàn toàn 2,7 gam nhôm trong không khí .
a) Tính thể tích không khí cần dùng ở đktc ? Biết oxi chiếm 1/5 thể tích không khí .
b) Tính khối lượng chất tạo thành sau phản ứng ?
BÀI 3.OXIT
1. Cho các oxit sau : SO2 , H2O , ZnO .
a) Chúng được tạo thành từ những đơn chất nào ?
b) Viết phương trình hóa học của phản ứng điều chế các oxit trên từ những oxit đó ?
2. Phân loại và đọc tên các oxit sau : K2O, BaO, Al2O3 , FeO, PbO, Fe3O4 , CuO, Cu2O, CO2 , N2O5,NO2 ,P2O5 ,SO2 , SO3 ,SiO2 ,Fe2O3 .
3. Viết công thức hóa học của các bazơ ứng với các oxit sau : FeO, K2O, CaO, Fe2O3 , CuO,Al2O3 , MgO,HgO .
4. Trong oxit của một kim loại có hóa trị II , nguyên tố kim loại chiếm 60% về khối lượng . Xác định công thức hóa học của oxit ? Viết phương trình hóa học điều chế oxit trên từ những đơn chất .
BÀI 4. ĐIỀU CHẾ OXI-PHẢN ỨNG PHÂN HỦY
1. Hoàn thành phương trình hóa học theo sơ đồ sau và cho biết phản ứng nào thuộc loại phản ứng phân hủy
a) KNO3 --> KNO2 + O2
b) HgO --> Hg + O2
c) ZnS + O2 --> ZnO + SO2
d) Cu(NO3)2 --> CuO + NO2 + O2
2. Tính khối lượng kali pemanganat KMnO4 cần dùng để điều chế được 5,6 lít khí oxi (đktc).
3. Nung 49 gam kali clorat KClO3 ( có xúc tác MnO2 ) . Tính khối lượng oxi thu được nếu hiệu suất của phản ứng đạt 80% .
4. Điện phân hoàn toàn 72 gam nước H2O .
a) Tính thể tích oxi thu được ở đktc .
b) Đốt cháy photpho trong lượng oxi trên . Tính khối lượng điphotpho pentaoxit P2O5 tạo thành sau phản ứng .
BÀI 5. KHÔNG KHÍ-SỰ CHÁY
1. Viết phương trình hóa học biểu diễn sự cháy trong oxi của các chất sau :
a) Sắt , cacbon , magie , lưu huỳnh . b) Axetilen C2H2 , hiđrosunfua H2S , sắt(II)sunfua FeS .
2. Hoàn thành phương trình hóa học theo sơ đồ sau và cho biết phản ứng nào thuộc loại phản ứng hóa hợp ? Phản ứng nào thuộc loại phản ứng phân hủy ?
a) NaNO3 - -> NaNO2 + O2
b) CaCO3 + CO2 + H2O - -> Ca(HCO3)2
c) K2O + H2O - -> KOH
d) Mg(NO3)2 - -> MgO + NO2 + O2
3. Đốt cháy hoàn toàn 4 gam lưu huỳnh trong không khí .
a) Tính thể tích không khí cần dùng ( đktc ) . Biết oxi chiếm 1/5 thể tích không khí .
b) Tính khối lượng và số phân tử chất tạo thành sau phản ứng .
ÔN TẬP CHƯƠNG IV
1. Viết phương trình hóa học biểu diễn sự cháy trong oxi của các đơn chất : nhôm, canxi, photpho, kẽm, đồng . Hãy gọi tên các chất sản phẩm .
2. Chọn chất thích hợp điền vào dấu ... và hoàn thành phương trình hóa học theo sơ đồ sau :
a) KMnO4 - - > ... + ... + O2
b) Mg + ... - - > MgO
c) H2O - - > ... + ...
d) KClO3 - - > KCl + O2
e) SO2 + ... - - > SO3
Cho biết mỗi phản ứng trên thuộc loại phản ứng hóa học nào ?
3. Khi nung nóng kali pemanganat KMnO4 , chất này bị phân hủy tạo ra khí oxi và hỗn hợp chất rắn . Tính khối lượng KMnO4 cần dùng để sinh ra lượng oxi đủ để đốt cháy 1,6 gam lưu huỳnh
4. Trong phòng thí nghiệm , khi đốt cháy sắt trong oxi ở nhiệt độ cao thu được oxit sắt từ Fe3O4 .
a) Tính khối lượng sắt và thể tích khí oxi ( đktc ) cần dùng để điều chế được 6,96 gam Fe3O4 .
b) Tính khối lượng kali clorat KClO3 cần dùng để điều chế được lượng oxi dùng cho phản ứng trên .
CHƯƠNG V. HIDRO-NƯỚC
BÀI 1. TÍNH CHẤT VÀ ỨNG DỤNG CỦA HIDRO
1. Viết phương trình hóa học của các phản ứng hiđro khử các oxit sau ở nhiệt độ cao :
a) Sắt ( II,III ) oxit b) Kẽm oxit c) Sắt ( II ) oxit
2. Dẫn luồng khí hiđro đi qua bột PbO nung nóng , sau phản ứng thu được 10,35 gam Pb . Tính khối lượng PbO và thể tích khí hiđro ( đktc ) tham gia phản ứng .
3. Điện phân hoàn toàn 0,27 kg nước .
a) Tính thể tích khí hiđro thu được ( đktc ) .
b) Cho lượng khí hiđro thu được ở trên tác dụng hết với bột sắt ( III ) oxit nung nóng . Tính khối lượng sắt(III)oxit đã tham gia phản ứng và khối lượng sắt tạo thành .
4. Khử hoàn toàn 4 gam oxit của kim loại M có hóa trị II phải dùng hết 1,12 lít khí hiđro ( đktc ) . Xác định công thức hóa học của oxit kim loại
BÀI 2. ĐIỀU CHẾ HIDRO-PHẢN ỨNG THẾ
1. Viết phương trình hóa học của phản ứng xảy ra khi cho các kim loại sau: Zn , Fe , Al , Mg lần lượt tác dụng với :
a) Dung dịch axit clohiđric .
b) Dung dịch axit sunfuric loãng .
2. Cho 6,5 gam kẽm vào bình dung dịch chứa 10,95 gam axit clohiđric .
a) Chất nào còn dư sau phản ứng ? Khối lượng là bao nhiêu gam ?
b) Tính thể tích khí hiđro thu được ( đktc ) ?
3. Cho sắt vào bình dung dịch chứa 19,6 gam axit sunfuric . Sau khi phản ứng kết thúc người ta thu được 3,36 lít khí hiđro (đktc).
a) Tính khối lượng sắt đã tham gia phản ứng .
b) Để có lượng sắt tham gia phản ứng trên phải cho bao nhiêu gam oxit sắt từ tác dụng với khí hiđro .
4. Cho 5,4 gam một kim loại hóa trị ( III ) tác dụng với lượng dư dung dịch axit sunfuric loãng , thu được 6,72 lít khí hiđro ( đktc ) . Xác định kim loại .
BÀI 3. NƯỚC
1.Viết phương trình hóa học của phản ứng xảy ra khi cho nước tác dụng với :
a) Li , K , Ca ,Ba .
b) Li2O , K2O , Na2O , BaO .
c) SO2 , SO3 , N2O5 .
2. Cho một hỗn hợp chứa 1,15 gam natri và 1,0 gam canxi vào lượng nước dư .
a) Tính thể tích khí hiđro ( đktc ) thu được ?
b) Dung dịch sau phản ứng làm quì tím đổi màu như thế nào ?
3. Cho 6 gam SO3 vào lượng nước dư , thu được dung dịch A .
a) Tính khối lượng chất tạo thành sau phản ứng ?
b) Cho nhôm tác dụng hết với dung dịch A . Tính thể tích khí ( đktc ) thu được ?
4. Cho 1,95 gam một kim loại có hóa trị I tác dụng hết với nước . Sau phản ứng thu được 0,56 lít khí hiđro ( đktc ) . Xác định kim loại ?
BÀI 4. AZIT-BAZO-MUỐI
1. Viết công thức hóa học và đọc tên của bazơ tương ứng với các oxit sau : K2O , Fe2O3 , ZnO , MgO , HgO , Al2O3
2. Viết công thức hóa học của các muối có tên gọi sau đây : Nhôm clorua , canxi sunfat , kali hiđrosunfat , magie photphat , natri sunfit , canxi hiđrocacbonat , kali sunfua , đồng ( II ) nitrat
3. Phân loại và đọc tên các hợp chất có công thức hóa học sau đây: Fe2O3 , Fe(OH)3 , HgO , Al(OH)3 , HNO3 , H3PO4 , Cu(OH)2 , K2HPO4 , MgCO3 , Na2S , Ba(HCO3)2 , FeCl2 , Ca(NO3)2 , SiO2 , H2SO3 .
4. Một hợp chất có thành phần khối lượng các nguyên tố như sau:19,167% Na , 0,833% H , 26,66% S , 53,333% O
a) Hãy xác định công thức hóa học của hợp chất biết phân tử khối của hợp chất là 120 .
b) Hợp chất trên thuộc loại hợp chất nào ? Đọc tên của hợp chất ?
ÔN TẬP CHƯƠNG V
1. Chọn chất thích hợp điền vào dấu ... và hoàn thành phương trình hóa học theo sơ đồ sau :
a) Fe2O3 + ... ---> Fe + ...
b) Al + H2SO4 ---> ... + H2
c) ... ---> H2 + O2
d) SO3 + ... ---> H2SO4
Mỗi phản ứng hóa học trên đây thuộc loại phản ứng nào ?
2. Có 4 chất khí đựng trong 4 lọ riêng biệt bị mất nhãn là : hiđro , oxi , không khí , cacbonđioxit . Hãy nhận biết các chất khí đựng trong mỗi lọ bằng phương pháp hóa học .
3. Cho 4,8 gam magie vào bình dung dịch chứa 21,9 gam axit clohiđric .
a) Chất nào còn thừa sau phản ứng ? Khối lượng là bao nhiêu gam ?
b) Tính khối lượng muối magie và thể tích khí hiđro ( đktc ) thu được sau phản ứng ?
4. Cho 16,2 gam oxit của một kim loại có hóa trị II tác dụng vừa đủ với dung dịch chứa 19,6 gam axit sunfuric . Xác định công thức hóa học của oxit kim loại.
5. Lập phương trình hóa học của các phản ứng sau và phân loại phản ứng :
a) Magie + axit Clohiđric
b) Kali oxit + nước
c) Kẽm + dung dịch đồng (II) sunfat
d) Sắt ( II , III ) oxit + hiđro
e) Lưu huỳnh đioxit + nước
6. Viết công thức hóa học của các chất có tên gọi sau : Sắt(III)sunfat , kali hiđro sunfat , magie hiđro cacbonat , đồng (II) hiđroxit , sắt (II) clorua , natri đihiđrophotphat , axit nitric , sắt (II) nitrat , nhôm sunfua , canxi clorua , natri sunfit , liti hiđroxit .
7. Cho 26 gam kẽm tác dụng với dung dịch loãng có chứa 24,5gam axit sunfuric
a) Chất nào dư sau phản ứng và dư bao nhiêu gam ?
b) Tính khối lượng muối tạo thành và thể tích khí hiđro thu được (đktc) .
8. Cho 8 gam oxit của một kim loại hóa trị II tác dụng với dung dịch axit clohiđric dư , sau phản ứng thu được 19 gam muối . Xác định công thức của oxit kim loại .
CHƯƠNG VII. DUNG DỊCH
BÀI 1. DUNG DỊCH
1. Hãy cho biết chất nào là dung môi ? Chất nào là chất tan trong các trường hợp sau :
a) Hòa tan đường vào nước
b) Hòa tan iot vào rượu etylic ( cồn )
c) Hòa tan cao su vào xăng
d) Hòa tan khí hiđro clorua HCl vào nước
e) Hòa tan rượu etylic vào nước
2. Cho biết ở nhiệt độ phòng thí nghiệm ( khoảng 200C ) , 10 gam nước có thể hòa tan tối đa 3,4 gam kali clorua KCl ; 8,8 gam natri nitrat NaNO3 . Nếu cho 5 gam KCl vào 10 gam nước và cho 5 gam NaNO3 vào 10 gam nước rồi khuấy đều thì dung dịch thu được là dung dịch bão hòa hay chưa bão hòa ? Vì sao ?
3. Tính phần trăm về khối lượng của nước trong :
a) Sođa: NaNO3 . 10 H2O b) Thạch cao sống CaSO4 . 2H2O
BÀI 2. ĐỘ TAN CỦA MỘT CHẤT
1. Tính khối lượng muối kali clorua KCl có thể tan trong 150 gam nước ở 20oC để tạo thành dung dịch bão hòa . Biết độ tan của KCl ở 20oC là 34 gam .
2. Ở 20oC , hòa tan 60 gam KNO3 vào 190 gam nước thì được dung dịch bão hòa . Hãy tính độ tan của KNO3 ở nhiệt độ đó .
3. Xác định khối lượng KCl kết tinh lại khi hạ nhiệt độ của 453 gam dung dịch KCl bão hòa từ 80oC xuống 20oC . Biết độ tan của KCl ở 80oC là 51 gam và ở 20oC là 34 gam .
BÀI 3. NỒNG ĐỘ DUNG DỊCH
1. Ở 20oC, độ tan của KCl là 34 gam . Hãy tính nồng độ phần trăm của dung dịch KCl bão hòa ở nhiệt độ này.
2. Hòa tan 4,7 gam K2O vào 195,3 gam nước . Tính nồng độ phần trăm của dung dịch thu được.
3. Cho kẽm tác dụng với dung dịch H2SO4 20% sau phản ứng thu được 10,08 lít khí hiđro (đktc).
a) Tính khối lượng kẽm tham gia phản ứng .
b) Tính khối lượng dung dịch H2SO4 20% cần dùng
4. Cho nhôm tác dụng hết với 150 gam dung dịch HCl 14,6% .
a) Tính khối lượng nhôm tham gia phản ứng .
b) Tính nồng độ % của dung dịch thu được .
BÀI 4. PHA CHẾ DUNG DỊCH
1. Từ dung dịch MgCl2 1,25M , hãy trình bày cách pha chế 100 ml dung dịch MgCl2 0,5M .
2. Tính số gam NaOH và số gam nước cần dùng để pha chế thành :
a) 120 gam dung dịch NaOH nồng độ 15% .
b) 250 gam dung dịch NaOH nồng độ 4% .
3. Tính nồng độ phần trăm của dung dịch thu được trong các trường hợp sau :
a) Pha thêm 30 gam nước vào 120 gam dung dịch H2SO4 nồng độ 10% .
b) Hòa tan thêm 5 gam KOH vào 195 gam dung dịch KOH nồng độ 8% .
4. Tính nồng độ mol của dung dịch thu được khi trộn 150 ml dung dịch HCl 1,5M với 100 ml dung dịch HCl 2M .
ÔN TẬP CHƯƠNG VI
1. Hòa tan 57,2 gam Na2CO3 .10H2O vào một lượng nước vừa đủ để tạo thành 400 ml dung dịch . Xác định nồng độ phần trăm và nồng độ mol của dung dịch . Biết dung dịch này có khối lượng riêng D = 1,05 g/ml .
2. Hòa tan 10 gam SO3 vào 150 gam dung dịch H2SO4 9,8% . Tính nồng độ phần trăm của chất có trong dung dịch thu được .
3. Có 150 gam dung dịch NaOH 8% ( dung dịch A ) .
a) Cần cho thêm vào dung dịch A bao nhiêu gam nước để được dung dịch NaOH 5% .
b) Cần cho thêm bao nhiêu gam NaOH vào dung dịch A để được dung dịch NaOH 20% .
4. Cho kẽm tác dụng hết với 150 gam dung dịch H2SO4 19,8 % .
a) Tính khối lượng kẽm tham gia phản ứng .
b) Tính nồng độ phần trăm của chất có trong dung dịch sau phản ứng .
ÔN TẬP HỌC KÌ II
A.TRẮC NGHIỆM KHÁCH QUAN:
Khoanh tròn vào một chữ cái A, B, C hoặc D đứng trước phương án chọn đúng:
Oxit là:
A. Hợp chất của oxi với 1 nguyên tố khác B. Hợp chất gồm 2 nguyên tố, trong đó có 1 nguyên tố là oxi.
C. Hợp chất được tạo bởi nguyên tố oxi và 1 nguyên tố nào đó. D. Cả A, B, C đúng.
Oxit axit là:
A. Là oxit của phi kim và tương ứng với 1 axit B. Là oxit của kim loại và tương ứng với 1 axit
C. Là oxit của phi kim và tương ứng với 1 oxit axit D. Thường là oxit của phi kim và tương ứng với 1 axit
Oxit bazơ là:
A. Là oxit của phi kim và kim loại, tương ứng với 1 bazơ B. Là oxit của kim loại và tương ứng với 1 bazơ
C. Thường là oxit của phi kim và tương ứng với 1 bazơ D. Là oxit của phi kim và tương ứng với 1 oxit axit
Cho các oxit sau: CO2, SO2, Fe2O3, P2O5, K2O. Trong đó có:
A. Hai oxit axit và 3 oxit bazơ B. Ba oxit axit và 2 oxit bazơ
C. Một oxit axit và 4 oxit bazơ D. Bốn oxit axit và 1 oxit bazơ
Cho các oxit sau: CaO, SO2, Fe2O3, P2O5, K2O. Trong đó có:
A. Hai oxit axit và 3 oxit bazơ B. Ba oxit axit và 2 oxit bazơ
C. Một oxit axit và 4 oxit bazơ D. Bốn oxit axit và 1 oxit bazơ
Cho các oxit sau: CO2, SO2, Fe2O3, P2O5, Mn2O7. Trong đó có:
A. Hai oxit axit và 3 oxit bazơ B. Ba oxit axit và 2 oxit bazơ
C. Một oxit axit và 4 oxit bazơ D. Bốn oxit axit và 1 oxit bazơ
Cho các oxit sau: CuO, BaO, Fe2O3, P2O5, K2O. Trong đó có:
A. Hai oxit axit và 3 oxit bazơ B. Ba oxit axit và 2 oxit bazơ
C. Một oxit axit và 4 oxit bazơ D. Bốn oxit axit và 1 oxit bazơ
Cho các oxit có công thức hóa học sau:
CO2 ; CO ; CaO ; P2O5 ; NO2 ; Na2O ; MgO ; N2O5 ; Al2O3
a) Các oxit axit được sắp xếp như sau:
A. CO2 ; CO ; NO2 ; Na2O B. CO ; CaO ; P2O5 ; N2O5
C. CO2 ; P2O5 ; NO2 ; N2O5 D. CaO ; P2O5 ; Na2O ; Al2O3
b) Các oxit bazơ được sắp xếp như sau:
A. CaO ; Na2O; MgO ; N2O5 B. CaO ; MgO ; Na2O ; Al2O3
C. CaO ; P2O5 ; Na2O ; Al2O3 D. MgO ; N2O5 ; Na2O ; Al2O3
Trong các oxít sau đây, oxít nào tác dụng được với nước.
A. SO3, CuO, Na2O, B. SO3 , Na2O, CO2, CaO.
C. SO3, Al2O3, Na2O. D. Tất cả đều sai.
Trong những chất sau đây, chất nào là axít .
A. H2SiO3, H3PO4, Cu(OH)2, Na2SiO3 B. HNO3, Al2O3, NaHSO4, Ca(OH)2.
C. H3PO4, HNO3, H2SiO3. D. Tất cả đều sai.
Dãy chất nào chỉ gồm toàn axit:
A. HCl; NaOH B. CaO; H2SO4 C. H3PO4; HNO3 D. SO2; KOH
Dãy chất nào sau đây gồm toàn oxit bazơ:
A. Fe2O3 , CO2, CuO, NO2 B. Na2O, CuO, HgO, Al2O3
C. N2O3, BaO, P2O5 , K2O D. Al2O3, Fe3O4, BaO, SiO2.
Dãy hợp chất gồm các bazơ tan trong nước :
A. Mg(OH)2 ; Cu(OH)2 ; Fe(OH)3 B. NaOH ; KOH ; Ca(OH)2
C. NaOH ; Fe(OH)2 ; AgOH D. Câu b, c đúng
Dãy hợp chất gồm các bazơ đều không tan trong nước :
A. Mg(OH)2 ; Cu(OH)2 ; Fe(OH)3 B. NaOH ; KOH ; Ca(OH)2
C. NaOH ; Fe(OH)2 ; LiOH D. Al(OH)3 ; Zn(OH)2 ; Ca(OH)2.
Dãy các chất nào sau đây đều tan trong nước:
A. NaOH, BaSO4, HCl, Cu(OH)2. B. NaOH, HNO3, CaCO3, NaCl.
C. NaOH, Ba(NO3)2 , FeCl2, K2SO4. D. NaOH, H2SiO3, Ca(NO3)2, HCl.
Dung dịch làm quỳ tím hóa đỏ là :
A. H2O B. Dung dịch NaOH
C. Dung dịch H2SO4 D. Dung dịch K2SO4
Trong số những chất có công thức HH dưới đây, chất nào làm cho quì tím không đổi màu:
A. HNO3 B. NaOH C. Ca(OH)2 D. NaCl
Có thể phân biệt các dung dịch axit, muối ăn, kiềm bằng cách dùng :
A. Nước cất B. Giấy quỳ tím C. Giấy phenolphtalein D. Khí CO2
*Có những chất rắn sau: FeO, P2O5, Ba(OH)2, NaNO3. Thuốc thử được chọn để phân biệt các chất trên là:
A. dung dịch H2SO4, giấy quỳ tím. B. H2O, giấy quỳ tím.
C. dung dịch NaOH, giấy quỳ tím. D. dung dịch HCl, giấy quỳ.
Dãy chất nào sau đây gồm toàn muối:
A. KCl, HNO3, CuCl2, NaHCO3 B. NaNO3, Al2(SO4)3, NaOH, H2S
C. ZnCl2, Mg(NO3)2, KCl, Na2S D. Cu(NO3)2, PbCl2, FeS2, AgCl.
Dãy chất nào sau đây gồm toàn muối không tan trong nước:
A. Na2SO3, Al2(SO4)3, KHSO4, Na2S B. KCl, Ba(NO3)2 , CuCl2, Ca(HCO3)2
C. ZnCl2, Mg(NO3)2, KCl, K2S D. BaSO4, AgCl, CaCO3, Ca3(PO4)2.
Cho biết phát biểu nào dưới đây là đúng:
A. Gốc cacbonat (CO3) và sunfat (SO4) hoá trị I B. Gốc photphat (PO4) hoá trị II
C. Gốc Clorua (Cl) và Nitrat (NO3) hoá trị III D. Nhóm hiđroxit (OH) hoá trị I
Từ công thức hoá học Fe2O3 và H2 SO4, công thức tạo bởi Fe và SO4 là:
A. FeSO4 B. Fe2 (SO4)3 C. Fe (SO4)3 D. Fe3(SO4)2
Cho các phương trình phản ứng sau:
1. Zn + 2HCl → ZnCl2 + H2
2. 2H2O 2H2 + O2
3. 2 Al + 3H2SO4 → Al2( SO4 )3 + 3H2
4. 2Mg + O2 2MgO
5. 2 KClO3 2KCl + 3O2
6. H2 + CuO Cu + H2O
7. 2H2 + O2 2 H2O
A. Phản ứng hoá hợp là: a. 1, 3 b. 2, 5 c. 4,7 d. 3, 6
B. Phản ứng phân huỷ là: a. 5, 6 b. 2 , 5 c. 4, 5 d. 2, 7
C. Phản ứng thế là: a. 1, 3, 6 b. 1, 3, 7 c. 3, 5, 6 d. 4, 6, 7.
Cặp chất nào sau đây dùng để điều chế oxi trong phòng thí nghiệm:
A. H2O, KClO3 B. KMnO4, H2O C. KClO3, KMnO4 D. HCl, Zn
Cho các khí: CO, N2, O2, Cl2, H2 .Các khí nhẹ hơn không khí là:
A. N2 , H2 , CO B. N2, O2, Cl2 C. CO, Cl2 D. Cl2,O2
Dãy gồm các chất khí nặng hơn không khí :
A. CO2 , H2 B. CO, CO2 C. N2, H2 D.SO2, O2
Ứng dụng của hiđro là:
A. Dùng làm nguyên liệu cho động cơ xe lửa B. Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng
C. Dùng để bơm vào khinh khí cầu
D. Tất cả các ứng dụng trên
Cách nào dưới đây thường dùng để điều chế hiđro trong phòng thí nghiệm:
A. Cho Zn tác dụng với dd HCl B. Điện phân nước
C. Cho Na tác dụng với nước D. Cho Cu tác dụng với dd H2SO4 đặc nóng
Tính chất hoá học của oxi là:
A. Tác dụng với kim loại B. Tác dụng với phi kim
C. Tác dụng với hợp chất D. Cả 3 tính chất trên
Sự oxi hóa là:
A. Sự tác dụng của oxi với 1 kim loại. B. Sự tác dụng của oxi với 1 phi kim.
C. Sự tác dụng của oxi với 1 chất. D. Sự tác dụng của oxi với 1 nguyên tố hoá học.
Sự oxi hóa chậm là:
A. Sự oxi hóa mà không tỏa nhiệt. B. Sự oxi hóa mà không phát sáng.
C. Sự oxi hóa toả nhiệt mà không phát sáng. D. Sự tự bốc cháy.
Biến đổi hoá học nào sau đây thuộc phản ứng oxi hoá - khử ?
A. Nung nóng canxi cacbonat (CaCO3) để sản xuất canxi oxit (CaO) B. Lưu huỳnh (S) cháy trong khí oxi (O2).
C. Canxi oxit (CaO) tác dụng với nước (H2O) thành canxi hiđroxit [Ca(OH)2 ]
D. Cacbon đioxit (CO2) tác dụng với nước (H2O) tạo axit cacbonic (H2CO3)
Nước là hợp chất mà phân tử được tạo bởi:
A. một nguyên tử H và một nguyên tử O B. hai nguyên tử H và một nguyên tử O
C. hai nguyên tử H và hai nguyên tử O D. một nguyên tử H và hai nguyên tử O.
Để tổng hợp nước người ta đã đốt cháy hoàn toàn 4,48 lít khí hiđro ( đktc) trong oxi. Thể tích khí oxi cần dùng là:
A. 2,24 lit B. 4,48 lit C. 44,8 lit D. 22,4 lit
Cho H2O tác dụng vừa đủ với Na. Sản phẩm tạo ra là:
A. Na2O B. NaOH và H2 C. NaOH D. Không có phản ứng.
Dung dịch là hỗn hợp:
A. Của chất rắn trong chất lỏng B. Của chất khí trong chất lỏng
C. Đồng nhất của chất rắn và dung môi D. Đồng nhất của dung môi và chất tan.
Nồng độ phần trăm của dung dịch là:
A.Số gam chất tan trong 100g dung môi B. Số gam chất tan trong 100g dung dịch
C.Số gam chất tan trong 1 lít dung dịch D. Số mol chất tan trong 1 lít dung dịch.
Dung dịch muối ăn 8 % là:
Dung dịch có 8 phần khối lượng muối ăn và 100 phần khối lượng nước.
Dung dịch có 8 phần khối lượng muối ăn và 92 ml nước .
Dung dịch có 8 phần khối lượng muối ăn và 92 phần khối lượng nước.
Dung dịch có 8 phần khối lượng nước và 92 phần khối lượng muối ăn.
Nồng độ mol/lít của dung dịch là:
A.Số gam chất tan trong 1 lít dung dịch B. Số gam chất tan trong 1lít dung môi
C.Số mol chất tan trong 1lít dung dịch D. Số mol chất tan trong 1lít dung môi.
Độ tan của một chất trong nước ở một nhiệt độ xác định là:
A.Số gam chất đó có thể tan trong 100g dung dịch B.Số gam chất đó có thể tan trong 100g nước
C.Số gam chất đó có thể tan trong 100g dung môi để tạo thành dung dịch bão hoà
D.Số gam chất đó có thể tan trong 100g nước để tạo thành dung dịch bão hoà
Khi hoà tan 100ml rượu êtylic vào 50ml nước thì:
A. Rượu là chất tan và nước là dung môi B. Nước là chất tan và rượu là dung môi
C. Nước và rượu đều là chất tan D. Nước và rượu đều là dung môi
Khi tăng nhiệt độ và giảm áp suất thì độ tan của chất khí trong nước thay đổi như thế nào?
A. Tăng B. Giảm C. Có thể tăng hoặc giảm D. Không thay đổi
Khi tăng nhiệt độ thì độ tan của chất rắn trong nước thay đổi như thé nào?
A. Đều tăng B. Đều giảm C. Phần lớn tăng D. Phần lớn giảm
Muốn tăng tốc độ hoà tan của chất rắn vào chất lỏng, ta thường:
A. tăng nhiệt độ của chất lỏng B. nghiền nhỏ chất rắn
C. khuấy trộn D. A, B, C đều đúng.
Với một lượng chất tan xác định khi tăng thể tích dung môi thì:
A. C% tăng,CM tăng B. C% giảm ,CM giảm C. C% tăng,CM giảm D. C% giảm,CM tăng
Để tính nồng độ mol của dung dịch NaOH, người ta làm thế nào?
Tính số gam NaOH có trong 100g dung dịch B. Tính số gam NaOH có trong 1000g dung dịch
C.Tính số gam NaOH có trong 1 lít dung dịch D.Tính số mol NaOH có trong 1 lít dung dịch
Để tính nồng độ phần trăm của dung dịch HCl, người ta làm thế nào?
A.Tính số gam HCl có trong 100g dung dịch B.Tính số gam HCl có trong 1lít dung dịch
C.Tính số gam HCl có trong 1000g dung dịch D.Tính số mol HCl có trong 1lít dung dịch
Trong thí nghiệm cho từ từ 2 muỗng đường vào nước. Dung dịch đường này có thể hòa tan thêm đường,
A. Dung dịch đường bão hòa B. Dung dịch đường chưa bão hòa
C. Dung dịch đồng nhất D. Cả A, B, C đều đúng
Trong phòng thí nghiệm, muốn chuyển đổi dung dịch NaCl bão hòa thành một dung dịch chưa bão hòa, ta cần:
A. Cho thêm nước B. Cho thêm muối C. Đun nóng dung dịch muối D. Cả A,C đúng.
B/ BÀI TẬP:
1. Nhiệt phân hoàn toàn 12,25g KClO3. Tính thể tích khí O2 ( ở đktc) thu được ?
2. Muốn điều chế được 48 g O2 thì khối lượng KClO3 cần nhiệt phân là bao nhiêu g ?
3. Muốn điều chế được 2,8 lít O2 (ở đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu ?
4. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Để điều chế được 2,32g Fe3O4 cần dùng :
a/ Bao nhiêu gam sắt ?
b/ Bao nhiêu lít khí O2 ( ở đktc) :
5. Đốt cháy 1kg than trong khí O2, biết trong than có 10% tạp chất không cháy.Tính:
a. thể tích oxi (đktc) cần thiết để đốt cháy 1kg than trên.
b. thể tích khí cacbonic CO2 (đktc) sinh ra trong phản ứng trên
6. Người ta dùng đèn xì oxi –axetilen để hàn cắt kim loại. Phản ứng cháy của axetilen C2H2 trong oxi tạo thành khí cacbonic và hơi nước. Hãy tính thể tích oxi (đktc) cần thiết để đốt cháy 1mol C2H2
7. Đốt cháy hoàn toàn 5,4g nhôm. Tính :
a. thể tích khí O2 (đktc) cần dùng ?
b. số gam KMnO4 cần dùng để điều chế lượng khí O2 trên ?
8. Xác định công thức hóa học của nhôm oxit, biết tỉ lệ khối lượng của 2 nguyên tố nhôm và oxi bằng 4,5 : 4.
9. Một oxit của lưu huỳnh trong đó oxi chiếm 60% về khối lượng. Tìm công thức phân tử của oxit đó?
10. Cho 5,6 g sắt vào 100 ml dung dịch HCl 1M . Hãy:
Tính lượng khí H2 tạo ra ở đktc?
Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu?
Tính nồng độ các chất sau phản ứng?
11. Nếu đốt cháy 13,5g nhôm trong một bình kín chứa 6,72 lít oxi (ở đktc) tạo thành nhôm oxit Al2O3 thì :
a/ Chất nào còn dư sau phản ứng? Số gam chất dư ?
b/ Tính khối lượng Al2O3 tạo thành?
12. Đốt cháy 6,2g photpho trong bình kín chứa 7,84 lít oxi (ở đktc) tạo thành điphotpho pentaoxit P2O5 thì
a/ Chất nào còn dư sau phản ứng? Số gam chất dư ?
b/ Tính khối lượng P2O5 tạo thành?
13. Cho 28,4g điphotpho pentaoxit P2O5 vào cốc chứa 90g nước để tạo thành axit photphoric. Tinh khối lượng axit H3PO4 được tạo thành ?
14. Hoàn thành những phản ứng hóa học sau :
a/ . . . + . . . MgO
b/ . . . + . . . P2O5
c/ . . . + . . . Al2O3
d/ . . . + . . . Na2S
e/ H2O . . . + . . .
f/ KClO3 . . . + . . .
g/ . . . + . . . CuCl2
h/ KMnO4 K2MnO4 + MnO2 + . . .
i/ Mg + HCl . . . + . . .
j/ Al + H2SO4 . . . + . . .
k/ H2 + . . . Cu + . . .
l/ CaO + H2O . . .
Cho biết mỗi phản ứng hóa học trên thuộc loại phản ứng hoá học nào ?
15. Gọi tên, phân loại các chất sau: Ca(OH)2, NaOH, KOH, Mg(OH)2, HNO3, H2SO4, HCl, H3PO4, NaCl, FeO, CuO, K2SO4, Na3PO4, AgNO3, CaSO4, NaHCO3, MgO, NaHSO4, Ca(HCO3)2, NaH2PO4
16. Hãy phân biệt các chất sau :
a. 4 bình đựng riêng biệt các khí sau: không khí, khí oxi, khí hiđro, khí cacbonic
b. 3 lọ mất nhãn đựng dung dịch NaOH, H2SO4, Na2SO4
c. Có 3 gói bột mất nhãn chứa các chất sau : Na2O, SO3, MgO
17. Khử 48g đồng (II) oxit bằng khí hiđro. Khối lượng đồng kim loại thu được và thể tích khí hiđro (ở đktc) cần dùng là bao nhiêu ?
18. Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt (III) oxit và thu được 11,2g sắt. Tinh khối lượng sắt (III) oxit đã phản ứng ?
19. Khử 12g sắt (III) oxit bằng khí hiđro.Tính: thể tích khí hiđro (đktc) cần dùng và khối lượng sắt thu được ?
20. Người ta điều chế được 24g đồng bằng cách dùng hiđro khử đồng (II) oxit. Tính :khối lượng đồng (II) oxit bị khử và thể tích khí hiđro (đktc) đã dùng ?
21. Cho 22,4g sắt tác dụng với dung dịch loãng chứa 24,5g axit sunfuric. Tính :
Khối lượng chất còn dư sau phản ứng? Thể tích khí hiđro thu được ở đktc ?
22. Khi cho 13g kẽm tác dụng với 0,3 mol HCl. Khối lượng ZnCl2 được tạo thành trong phản ứng này là bao nhiêu gam?
23. Cho 19,5g kẽm tác dụng hết với dung dịch axit clohiđric. Hãy cho biết :
a/ Tính thể tích khí H2 (đktc) thu được
b/ Nếu dùng thể tích khí H2 trên để khử 19,2g sắt (III) oxit thì thu được bao nhiêu gam sắt ?
24. Thể tích khí hiđro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra được 1,8g nước là ?
25. Để có 1 dung dịch chứa 16g NaOH, cần phải lấy bao nhiêu gam Na2O cho tác dụng với nước ?
26.Cho 9,2g Na vào nước dư thì thu được dung dịch NaOH và khí H2. Tính thể tích khí H2 (đktc) thoát ra và khối lượng NaOH tạo thành ?
27. Khối lượng mol của 1 oxit kim loại là 160gam, thành phần về khối lượng của kim loại trong oxit đó là 70%. Xác định công thức hóa học của oxit ?
28. Lập phương trình hoá học của các phản ứng sau và cho biết các phản ứng trên thuộc loại phản ứng nào?
a/ Sắt (III) oxit + hiđro sắt + nước
b/ Lưu huỳnh trioxit + nước axit sunfuric
c/ Nhôm + sắt (III)oxit sắt + nhôm oxit
d/ Canxi oxit + nước canxi hiđroxit
e/ Kali + nước kali hiđroxit + khí hiđro
f/ Kẽm + axit sufuric (loãng) kẽm sunfat + khí hiđro
29. Hãy tính nồng độ mol của mỗi dung dịch sau:
a/ 1 mol KCl trong 750ml dung dịch
b/ 400g CuSO4 trong 4 lít dung dịch
c/ 0,5mol MgCl2 trong 1,5 lít dung dịch
d/ 0,06mol Na2CO3 trong 1500ml dung dịch
30. Hãy tính số mol và số gam chất tan trong mỗi dung dịch sau:
a/ 500ml dung dịch KNO3 2M
b/ 250ml dung dịch CaCl2 0,1M
31. Tính nồng độ % của những dung dịch sau :
a. 20g KCl trong 600g dung dịch
b. 75g K2SO4 trong 1500g dung dịch
c. Hòa tan 15g NaCl vào 45g nước
d. Hòa tan 4,48 lít khí hiđro clorua HCl ( đktc) vào 500g nước
32. Tính số gam chất tan cần dùng để pha chế mỗi dung dịch sau:
a/ 2,5 lít dung dịch NaCl 0,9M
b/ 250 ml dung dịch MgSO4 0,1M
c/ 50g dung dịch MgCl2 4%
d/ 200g dung dịch KCl 15%
33. Để pha chế 250ml dung dịch NaOH 0,5M cần bao nhiêu ml dung dịch NaOH 2M và bao nhiêu ml nước?
34. Cho 200 g dung dịch NaOH 20% tác dụng vừa hết với 100 g dung dịch HCl . Tính:
Nồng độ muối thu được sau phản ứng?.
Tính nồng độ axit HCl. Biết phản ứng xảy ra hoàn toàn?.
35. Hòa tan hoàn toàn 10,6g Na2CO3 vào nước đựơc 200ml dung dịch Na2CO3. Tính nồng độ phần trăm và nồng độ mol của dung dịch trên. Biết khối lượng riêng của dung dịch là 1,05g/ml.
36. Hãy tính:
1. Số mol của Kali hiđrôxit trong 28 gam dung dịch KOH 10%..
2. Nồng độ phần trăm của dung dịch tạo thành khi cho 36 gam đường vào 144 gam nước ?
3. Nồng độ mol của dung dịch NaOH, biết rằng trong 80 ml dung dịch này có chứa 0,8 gam NaOH 37. Dùng 500 ml dung dịch H2SO4 1,2M để hoà tan hết lượng kim loại sắt, phản ứng tạo thành sắt (II) sunfat và khí hiđro.
a) Viết phương trình hoá học của phản ứng.
b) Tính khối lượng muối sắt(II) sunfat thu được.
c) Tính thể tích khí H2 thoát ra (ở đktc) ? (Cho Fe = 56; H = 1; O = 16; S = 32)
38. Hòa tan 32,5 gam Zn bằng dung dịch HCl, sau phản ứng tạo ra muối kẽm clorua (ZnCl2) và khí H2.
a) Hãy viết phương trình hóa học của phản ứng ?
b) Tính khối lượng muối ZnCl2 và thể tích H2 tạo thành sau phản ứng ? (Biết các khí đo ở điều kiện tiêu chuẩn) (Cho Zn = 65; H = 1; O = 16; Cl = 35,5)
39. Cho 8,1 g Al tác dụng vừa đủ với dung dịch HCl
a) Hoàn thành phương trình hoá học.
b) Tính thể tích khí hiđro tạo thành (ở đktc)
c) Tính khối lượng AlCl3 tạo thành. (Biết Al = 27, H = 1, O = 16, Cl = 35,5).
40. Cho a gam kim loại Kẽm vào 400 ml dung dịch HCl. Sau khi phản ứng kết thúc thu được 2,24 lít khí Hiđro ( ở đktc).
a) Viết phương trình hoá học xảy ra.
b) Tính a.
c) Tính nồng độ mol/lít của dung dịch HCl đã tham gia phản ứng.
41. Cho 6,5g Zn tác dụng với 100g dung dịch HCl 14,6%.
a) Viết phương trình phản ứng xảy ra.
b) Chất nào còn dư lại sau phản ứng, với khối lượng là bao nhiêu?
c) Tính thể tích khí Hidro thoát ra ở ĐKTC (Cho Zn = 65; H = 1; O = 16; Cl = 35,5)
42. Cho 13 gam Zn tác dụng với dung dịch có chứa 18,25 gam HCl.
Tính xem chất nào còn dư sau phản ứng và khối lượng dư là bao nhiêu ?
Tính khối lượng ZnCl2 tạo thành sau phản ứng.
Tính thể tích khí H2 thu được ở đktc. (Cho Zn = 65; H = 1; O = 16; Cl = 35,5)
43. Người ta dẫn luồng khí H2 đi qua ống đựng 4,8 gam bột CuO được nung nóng trên ngọn lửa đèn cồn, cho đến khi toàn bộ lượng CuO màu đen chuyển thành Cu màu đỏ thì dừng lại.
Viết phương trình phản ứng xảy ra ?
Tính số gam Cu sinh ra?
Tính thể tích khí hiđrô (đktc) vừa đủ dùng cho phản ứng trên ?
Để có lượng H2 đó phải lấy bao nhiêu gam Fe cho tác dụng vừa đủ với bao nhiêu gam axít HCl. (Cho Cu = 64; H = 1; O = 16; Cl = 35,5)
44. Cho 13 gam kẽm phản ứng hoàn toàn với dung dịch HCl.
1. Viết phương trình hoá học
2. Tính thể tích khí hidro sinh ra (đktc)
3. Nếu dùng toàn bộ lượng H2 bay ra ở trên đem khử 12 gam bột CuO ở nhiệt độ cao thì chất nào còn dư bao nhiêu gam ? ( Zn = 65 ; Cl = 35,5 ; Cu = 64 ; O = 16 ; H= 1 )
ĐỀ CƯƠNG ÔN TẬP
DẠNG 1: HOÀN THÀNH PTHH
Bài 1. Hoàn thành và xác định những phản ứng hóa học sau :
a) . . . + . . . MgO
b) . . . + . . . P2O5
c) . . . + . . . Al2O3
e) H2O . . . + . . .
f) KClO3 . . . + . . .
g) KMnO4 K2MnO4 + MnO2 + . . .
h) Mg + HCl . . . + . . .
i) Al + H2SO4 . . . + . . .
j) H2 + . . . Cu + . . .
k) CaO + H2O . . .
Bài 2. a. Hoàn thành các phương trình phản ứng sau:
P + O2 P2O5
SO2 + O2 SO3
Al + O2 Al2O3
C2H4 + O2 CO2 + H2O
b. Cho biết vai trò của oxi trong các phản ứng trên.
Bài 3. Viết PTPỨ hóa học theo sơ đồ:
a. K K2O KOH KHCO3 K2CO3 KHCO3
b. Na Na2O NaOH NaCl
(4)
NaOH Na2SO4
DẠNG 2: BÀI TẬP VỀ PHẦN AXIT- BAZO- MUỐI
Bài 1: Cho các chất sau: MgO, Al2O3 , SO3, SiO2, SO2, CO2, P2O5, N2O5, Fe2O3 . Phân loại oxit. Viết công thức bazơ hoặc axit tương ứng và gọi tên các chất.
Bài 2.Cho các chất sau: CaCO3, Na2SO4, Cu2O, Na2O, HCl, ZnSO4, Fe(OH)2, H3PO4, Ca(OH)2, CuOH, CO, CO2, KHSO4, N2O5, P2O5, HNO3, NaHCO3, Fe2(SO4)3, Na3PO4 . Phân loại và đọc tên các chất.
Bài 3.Cho các chất có công thức hóa học sau; CaCl2, Cu2O, Na2O, KHSO4, Al(SO4)3, Na2PO4, AlO3, MgNO3, NaCO3, CaCO3, Fe2( SO4)3. Công thức nào sai, sửa lại cho đúng và đọc tên sản phẩm .
DẠNG 3:NHẬN BIẾT CHẤT VÀ TÁCH CHẤT
Bài 1.. Hãy phân biệt các chất sau :
a. Có 4 bình đựng riêng biệt các khí sau: không khí, khí oxi, khí hiđro, khí cacbonic
b. Có 3 lọ mất nhãn đựng các khí H2; O2, và CO2. Hãy nhận biết các khí.
c. Có 3 lọ mất nhãn đựng các khí : H2; O2, và không khí. Hãy nhận biết các chất
Bài 2.Hỗn hợp gồm bột: nhôm, sắt, đường. Hãy trình bày cách để tách riêng từng chất .
DẠNG 4: TÍNH THEO PTHH
Bài 1. Cho 8,1 g Al tác dụng vừa đủ với dung dịch HCl
a. Hoàn thành phương trình hoá học.
b. Tính thể tích khí hiđro tạo thành (ở đktc)
c. Tính khối lượng AlCl3 tạo thành. (Biết Al = 27, H = 1, O = 16, Cl = 35,5).
Bài 2.Cho 9,2g Na vào nước dư thì thu được dung dịch NaOH và khí H2. Tính thể tích khí H2 (đktc) thoát ra và khối lượng NaOH tạo thành ?
Bài 3. Cho 13 gam kẽm phản ứng hoàn toàn với dung dịch HCl.
1. Viết phương trình hoá học
2. Tính thể tích khí hidro sinh ra (đktc)
3. Nếu dùng toàn bộ lượng H2 bay ra ở trên đem khử 12 gam bột CuO ở nhiệt độ cao thì chất nào còn dư bao nhiêu gam ? ( Zn = 65 ; Cl = 35,5 ; Cu = 64 ; O = 16 ; H= 1 )
Bài 4. Cho 13 gam Zn tác dụng với dung dịch có chứa 18,25 gam HCl.
Tính xem chất nào còn dư sau phản ứng và khối lượng dư là bao nhiêu ?
Tính khối lượng ZnCl2 tạo thành sau phản ứng.
Tính thể tích khí H2 thu được ở đktc. (Cho Zn = 65; H = 1; O = 16; Cl = 35,5)
Bài 5. Cho 19,5g kẽm tác dụng hết với dung dịch axit clohiđric. Hãy cho biết :
a. Tính thể tích khí H2 (đktc) thu được
b. Nếu dùng thể tích khí H2 trên để khử 19,2g sắt (III) oxit thì thu được bao nhiêu gam sắt ?
Bài 6. Một dung dịch chứa 7,665 g HCl. Cho 16 g CuO vào đó và khuấy đều
a) Sau phản ứng chất nào dư, dư bao nhiêu g
b) Tính khối lượng CuCl2 thu được
Bài 7. Cho 10 g CaCO3 vào dung dịch chứa 5,475 g HCl.
a) Sau phản ứng, chất nào dư, dư bao nhiêu g
b) Tính thể tích khí CO2 thu được ở đktc
c) Muốn phản ứng xảy ra vừa đủ, cần phải thêm chất nào, thêm bao nhiêu g
Bài 8. Cho sơ đồ phản ứng sau:
NaOH + FeCl3 NaCl + Fe(OH)3
Biết có 6g NaOH đã được cho vào dung dịch chứa 32,5 g FeCl3, khuấy đều
a. Chất nào dư sau phản ứng, dư bao nhiêu g
b.Tính khối lượng kết tủa thu được?
Bài 9. Hòa tan 13,5 gam nhôm ( Al) trong dung dịch axit clohiđric ( HCl).
a. Viết phương trình xảy ra.
b. Tính thể tích khí H2 sinh ra ( ĐKTC).
c. Dẫn hết khí H2 sinh ra qua bình đựng 64,8 gam sắt (II) oxit thì khối lượng Fe thu được là bao nhiêu?
d. Cho dung dịch H2SO4 dư vào chất rắn sau khi nung, cô cạn dung dịch sau phản ứng thì thu được bao nhiêu gam muối khan ?
DẠNG 5:BÀI TẬP CÓ LIÊN QUAN ĐẾN NỒNG ĐỘ DUNG DỊCH
Bài 1. Hãy tính số mol và số gam chất tan trong mỗi dung dịch sau:
a/ 500ml dung dịch KNO3 2M
b/ 250ml dung dịch CaCl2 0,1M
Bài 2. Tính nồng độ % của những dung dịch sau :
a. 20g KCl trong 600g dung dịch
c. Hòa tan 15g NaCl vào 45g nước
Bài 3. Cho 5,6 g sắt vào 100 ml dung dịch HCl 1M . Hãy:
Tính lượng khí H2 tạo ra ở đktc?
Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu?
Tính nồng độ các chất sau phản ứng?
Bài 4. Cho a gam kim loại Kẽm vào 400 ml dung dịch HCl. Sau khi phản ứng kết thúc thu được 2,24 lít khí Hiđro ( ở đktc).
a) Viết phương trình hoá học xảy ra.
b) Tính a.
c) Tính nồng độ mol/lít của dung dịch HCl đã tham gia phản ứng.
Bài 5. Cho 2,7 gam Al tác dụng với 100g dung dịch H2SO4 9,8%.
a. Viết PTHH xảy ra.
b. Tính khối lượng muối tạo thành.
c. Tính thể tích H2 ( ĐKTC)
Bài 6. Hãy tính toán và trình bày cách pha chế :
a. 400 gam dung dịch CuSO4 4%
b. 300 ml dung dịch NaCl 3M
c. 150 g dung dịch CuSO4 2% từ dung dịch CuSO4 20%
d.250 ml dung dịch NaOH 0,5M từ dung dịch NaOH 2M
DẠNG 6:XÁC ĐỊNH CTHH DỰA VÀO PTHH
Bài 1. Cho 7,2g một kim loại hoá trị II phản ứng hoàn toàn 100 ml dung dịch HCl 6M. Xác định tên kim loại đã dùng.
Bài 2.Đốt cháy hoàn toàn 7,2 g kim loại R có hóa trị II thu được 12 g oxit. Xác định tên nguyên tố R trên.
Bài 3.Cho 7,2g một kim loại M chưa rõ hóa trị , phản ứng hoàn toàn với 21,9 g HCl . Xác định tên kim loại đã dùng.
DẠNG 7: BÀI TẬP DẠNG DƯ
Bài 1. Cho 5,4g nh«m vµo cèc ®ùng d.d lo·ng chøa 30g H2SO4.
a. Sau ph¶n øng nh«m hay axit cßn d?
b. TÝnh thÓ tÝch H2 thu ®îc ë ®kc?
c. TÝnh khèi lîng c¸c chÊt cßn l¹i trong cèc?
Bài 2. Cho mét l¸ nh«m nÆng 0,81g vµo d.d chøa 2,19g HCl.
a. ChÊt nµo ph¶n øng hÕt, chÊt nµo cßn d?
b.TÝnh khèi lưîng c¸c chÊt thu ®îc sau ph¶n øng.
Bài 3. Trén 5,6 lÝt H2 vµ 5,6 lÝt khÝ O2 (®kc) råi ®èt ch¸y. Hái sau ph¶n øng khÝ nµo d, d bao nhiªu lit? TÝnh khèi lîng níc t¹o thµnh?
Bài 4. Dẫn 3,36 lít khí H2 (dktc) qua ống sứ chưa 1,6 g CuO nung nóng. Chờ cho phản ứng kết thúc
a. CuO có bị khử hết không?
b. Tính khối lượng Cu thu được sau phản ứng
Bài 5. Hòa 20,4 g Al2O3vào dung dịch chứa 17,64 g H2SO4. Sau phản ứng:
a. Chất nào dư, dư bao nhiêu g
b. Tính khối lượng Al2(SO4)3 thu được
DẠNG 8- BÀI TẬP TỔNG HỢP
Bài 1. Cho H2 khử 16 gam hỗn hợp CuO và Fe2O3 trong đó khối lượng CuO chiếm 25%
a.Tính khối lượng của Sắt và khối lượng Cu thu được sau phản ứng.
b.Tính tổng thể tích H2 đã tham gia phản ứng.
Bài 2. Một oxit ba zơ có thành phần % theo khối lượng của oxi là 7,17 %. Tìm công thức của oxit kim loại hóa trị II.
Bài 3. Dùng H2 để khử a gam CuO thu được b gam Cu. Cho lượng Cu này tác dụng với Cl2 thu được 33,75 g CuCl2. Tính a và b.
Bài 4. Cho các kim loại K, Ca, Al lần lượt tác dụng với dung dịch HCl.
a.Nếu cùng số mol của một trong các kim loại trên tác dụng với axit HCl thì kim loại nào cho nhiều khí H2 hơn.?
b. Nếu thu được cùng số mol khí H2 thì khối lượng kim loại nào ít hơn ?
Bài 5. Cho 8,6 gam Ca và CaO tác dụng với nước dư, thu được 1,68 lít khí hidro ( đktc)
a.Viết PTHH
b. Tính khối lượng mỗi chất trong hỗn hợp
c. Dung dịch thu được là hợp chất gì ? Đọc tên sản phẩm ?
Bài 6. Độ tan của muối án ( NaCl) ở 200C là 36 gam. Xác định nồng đọ % của dung dịch bão hòa ở nhiệt độ trên.
Bài 7. Biết độ tan của NH4Cl ở 20 0C là 37,2 gam. Hỏi có bao nhiêu gam muối NH4Cl có trong 300g dung dịch NH4Cl bão hòa.
Bài 8. a.Hòa tan 2 gam NaCl trong 80 gam H2O, Tính nồng độ phần trăm của dung dịch.
b. Chuyển sang nồng độ phần trăm dung dịch NaOh 2M có khối luowgj riêng d=1,08 g/ml.
c. Cần ba0 nhiêu gam NaOH để pha chế được 3 lít dung dịch NaOH 10% , biết khối lượng riêng của dung dịch là 1,115 g/ml.
ĐỀ THAM KHẢO HỌC KÌ II
Mã đề 01
I. Trắc nghiệm: (4 điểm)
Khoanh tròn vào chữ cái đứng trước câu trả lời đúng trong các câu sau:
Câu 1. Nhóm chất toàn là oxit bazơ:
A. Na2O, Fe3O4, CO. B. MgO, Al2O3, ZnO.
C. Fe2O3, P2O5, CuO. D. CaO, NO, BaO.
Câu 2. Phản ứng thế có đặc điểm
A. tạo ra nhiều sản phẩm từ một chất ban đầu.
B. chỉ tạo ra 1 sản phẩm duy nhất từ nhiếu chất ban đầu.
C. nguyên tử của đơn chất thay thế vị trí các ngyên tử của các nguyên tố trong hợp chất.
D. nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Câu 3. Muối là hợp chất trong thành phần phân tử có:
A. nguyên tử kim loại liên kết với nhóm hiđrôxit (-OH) B. nguyên tử kim loại liên kết với nguyên tử oxi.
C. nguyên tử kim loại liên kết với gốc axit. D. nguyên tử kim loại liên kết với nguyên tử clo.
Câu 4. Nồng độ % của dung dịch là:
A. số gam chất tan có trong 100g dung dịch. B. số gam chất tan có trong 100g dung môi.
C. số gam chất tan có trong 1lit dung dịch.
D. số gam chất tan có trong 100g dung môi để tạo thành dung dịch bão hòa.
Câu 5. Để điều chế khí hiđro trong phòng thí nghiệm, ta có thể dùng kim loại nhôm tác dụng với:
A. CuSO4 hoặc HCl loãng. B. H2SO4 loãng hoặc HCl loãng.
C. Fe2O3 hoặc CuO. D. KClO3 hoặc KMnO4.
Câu 6. Hiđro được dùng làm nhiên liệu cho động cơ tên lửa vì:
A. do tính chất rất nhẹ. B. khi cháy sinh nhiều nhiệt.
C. khi cháy sinh ít nhiệt. D. khi cháy không gây ô nhiễm môi trường
Câu 7 Nhóm chất làm quỳ tím chuyển màu xanh là
A. KOH, Al(OH)3, FeSO4. B. NaOH, KOH, Ca(OH)2, Ba(OH)2.
C. H2SO4, KOH, Al(OH)3, SO3 , Na2O. D. Ca(OH)2, Cu(OH)2, Fe(OH)3 , H2SO4.
Câu 8. Nhóm chất làm quỳ tím chuyển màu đỏ là
A. BaO, Na2O, CaO. B. SO3, P2O5, N2O5, CaO.
C. Ca(OH)2, Cu(OH)2, Fe(OH). D. HCl, HNO3, H3PO4, H2SO4.
II. Tự luận: (6 điểm)
Câu 1: (2điểm) Hãy chọn chất thích hợp để lập các phương trình phản ứng hóa học sau:
a. Mg + ? --- MgCl2 + H2
b. Ca + ? ---- CaO
c. KMnO4 ---- K2MnO4 + MnO2 + ?
d. Fe + ? ---- FeCl2 + Cu
Câu 2: (4 điểm)
Đốt cháy photpho theo sơ đồ:
P + O2 ---- P2O5.
a. Lập phương trình phản ứng.
b. Cần bao nhiêu lit O2 để đốt cháy hoàn toàn 15,5g P.
c. Để tạo ra 28,4g P2O5 thì cần bao nhiêu lít không khí( biết oxi chiếm 1/5 thể tích không khí).
( Biết thể tích các khí đo ở đktc. Cho P=31, O=16).
Mã đề 02
I. Trắc nghiệm): Chọn câu trả lời đúng và điền vào bảng.
Câu 1. Sự cháy là gì ?
A. Sự oxi hóa có phát sáng. B. Sự oxi hóa có tỏa nhiệt.
C. Sự oxi hóa có tỏa nhiệt nhưng không phát sáng. D. Sự oxi hóa có tỏa nhiệt và phát sáng.
Câu 2. Chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm:
A. K2O và KMnO4 B. KMnO4và KClO3 C. H2SO4và H2O D. KOH và KClO3
Câu 3.Các chất nào sau đây tan được trong nước:
A. NaCl, AgCl. B. HNO3, H2SiO3. C. NaOH, Ba(OH)2. D. CuO, AlPO4.
Câu 4. Phản ứng nào sau đây là phản ứng phân hủy:
A. 2KClO3 → 2KCl + 3O B. Fe3O4 + 4H2 → 3Fe + 4H2O.
C. SO3+ H2O → H2SO D. Fe2O3 + 6HCl → 2FeCl3 + 3H2O.
Câu 5. Dãy các chất hoàn toàn là công thức hóa học của các oxit :
A. SO2, CaO, P2O5, MgO, CuO B. SO2, CaO, KClO3, P2O5, MgO
C. CaO, H2SO4, P2O5, MgO, CuO D. SO2, CaO, KClO3, NaOH, O3
Câu 6. Độ tan của chất khí tăng khi:
A. Tăng nhiệt độ và tăng áp suất. B. Giảm nhiệt độ và giảm áp suất.
C. Tăng nhiệt độ và giảm áp suất. D. Giảm nhiệt độ và tăng áp suất.
II. Tự luận:
Câu 1. (1 điểm) Hoàn thành các phương trình hóa học sau:
a. K2O + H2O →
b. Na + H2O →
c. Cu + O2
d. CxHy + O2
Câu 2. (2 điểm) Hoà tan 2,8 gam kim loại sắt với 50ml dung dịch HCl (D = 1,18g/ml) thì vừa đủ.
a. Viết PTHH xảy ra.
b. Tính C% của dung dịch HCl.
c. Tính C% các chất sau phản ứng.
Câu 3. (1 điểm) Nung a gam KClO3 và b gam KMnO4 thu được cùng một lượng O2. Tính tỉ lệ a/b.
Mã đề 03
I. Trắc nghiệm: (4 điểm) Khoanh tròn vào câu đúng nhất trong số các câu sau
Câu 1. Cặp chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm?
A. KMnO4, KClO3 B. H2O, KClO3 C. K2MnO4, KClO3 D.KMnO4, H2O
Câu 2. Dãy nào sau đây gồm những oxit tác dụng với nước tạo ra dung dịch bazơ:
A. SO2, CaO, K2O. B. K2O, N2O5, P2O5. C. CaO, K2O, BaO D. K2O, SO2, P2O5.
Câu 3. Nhóm chất nào sau đây đều là axit ?
A.HCl, H2SO4, KOH B.NaOH, HNO3, HCl
C.H2SO4, HBr, H3PO4 D. HNO3, NaCl, H3PO4
Câu 4. Cặp chất nào sau đây có thể phản ứng được với nhau và gây nổ.
A. H2 và Fe B. H2 và CaO C. H2 và HCl D. H2 và O2
Câu 5. Oxi phản ứng với nhóm chất nào dưới đây ?
A. C, Cl2, Na B. S, C4H10, Fe C. Na, C4H10, Au D. Au, N2, Mg
Câu 6. Trong 200 ml dung dịch có hòa tan 16 gam CuSO4.Nồng độ mol của dung dịch là:
A. 0,5 M B. 0,05 M C. 0,2 M D. 0,02 M
Câu 7. Trộn lẫn 200 gam dung dịch NaCl 20%với 300 gam dung dịch NaCl 20%, thì nồng độ dung dịch sau là:
A. 20% B. 30% C. 40% D 50%
Câu 8. Tên gọi các chất : SO3, HNO3, Fe(OH)2, NaHCO3 là:
A. Lưu huỳnh đi oxit, axit nitric, Sắt (II) hiđrroxit, Natri hiđro cacbonat
B. Lưu huỳnh tri oxit, Axit nitrơ, Săt hiđroxit, natri hiđro cacbonat
C. Lưu huỳnh trioxit, axit nitric, Sắt (II) hiđrroxit, Natri hiđro cacbonat
D. Lưu huỳnh oxit, axit nitrat, Sắt (III) hiđrroxit, Natri hiđro cacbonat
II. Tự luận (6 điểm)
Câu 9. (1 điểm)Hãy tính toán và giới thiệu cách pha chế: 50 gam dung dịch NaOH có nồng độ 40%
Câu 10. ( 2 điểm) Hoàn thành và xác định phản ứng hóa học sau:
a. K + ......... K2O ; c. KClO3 O2 + .........
b. Na + .......... NaOH +...... ; d. .......+ H2SO4 Al2(SO4)3 +.......
Câu 11. (3 điểm) Cho 11,2 gam Fe vào 100 ml dung dịch HCl 0,5M. Hãy:
a. Chất nào dư sau phản ứng và khối lượng dư bao nhiêu?
b. Tính thể tích khí H2 tạo ra ở điều kiện tiêu chuẩn.
c. Tính nồng độ các chất sau phản ứng.
( Cho biết Fe= 56, H=1, Cl=35,5)
..................................................Hết .....................................
Cán bộ coi thi không giải thích gì thêm
Mã đề 04
I.TRẮC NGHIỆM KHÁCH QUAN (4,0 điểm)
Câu 1. Khi tăng nhiệt độ thì độ tan của các chất rắn trong nước
A.đều tăng B. đều giảm
C.phần lớn là tăng D. không tăng và cũng không giảm.
Câu 2. Khí hi đro thu được bằng cách đẩy nước vì:
A.khí hi đro nhẹ hơn nước B. Khí hi đro ít tan trong nước
C.khí hi đro nhẹ nhất trong các chất khí D. hi đro là chất khử
Câu 3. Khí thu được khi cho mẫu Na vào nước có tính chất
Không duy trì sự cháy B. Làm đục nước vôi trong
C.cháy trong oxi tạo ra nước D. làm cục than hồng bùng sáng.
Câu 4. Trộn 200ml dung dịch KOH 0,25 M với 300 ml dung dịch KOH 0,5M. Dung dịch sau khi trộn có nồng độ mol là
0,75 M B. 0,4M C.0,5M D.2,5 M
Câu 5. Nhóm chất nào sau đây đều tác dụng với nước tạo thành dung dịch làm quỳ tím chuyển sang màu đỏ?
BaO, Na2O, CaO B. SO3, P2O5, N2O5
C.SO3, CaO, K2O D.P2O5, CO2, BaO
Câu 6.Có ba lọ mất nhãn đựng các khí O2; CO2, H2. Thuốc thử nào sau đây để phân biệt ba lọ trên dễ dàng nhất ?
Nước B. Que đóm C. Que đóm đang cháy D. Nước vôi trong
Câu 7.Số gam nước cần thêm vào để pha chế 50g dd MgCl2 4% là
A.45 gam B. 46 gam C. 47 gam D. 48 gam.
Câu 8. Ở nhiệt độ 25CC, độ tan của muối ăn là 36 gam. Nồng độ phần trăm của dung dịch muối bão hòa ở nhiệt độ trên là
26,47 % B. 26,50% C. 26,40% D. 26,00%
PHẦN TỰ LUẬN (6,0 điểm)
Câu 1. ( 2, 0 điểm) Cho các công thức hóa học sau: NaO, CO3, H2CO3, K(OH)2, Ba(OH)2, Zn2(SO4)2, Na2CO3, Ca(HSO4)2. Hãy cho biết công thức nào sai, sửa lại cho đúng ? Cho biết mỗi chất thuộc loại hợp chất nào? Gọi tên từng hợp chất.
Câu 2.(1,5 điểm) Viết PTHH biểu diễn chuổi biến hóa sau và cho biết mỗi phản ứng đó thuộc loại phản ứng nào ? Giải thích.
KMnO4 O2 CuO H2O KOH
(5)
Na2O NaOH
Câu 3. (2,5 điểm) Cho 200 gam dung dịch NaOH 20% tác dugj với 100 ml dung dịch HCl 1M.
Tính khối lượng của muối natri clo rua ( NaCl) tạo thành.
Nếu cho lượng dung dịch HCl ở trên tác dụng với bột sắt dư thì thu được bao nhiêu lít khí hiđro ở ĐKTC. Biết hiệu suất phản ứng đạt 90%.
Mã đề 05
I. PHẦN TRẮC NGHIỆM (4,0 điểm). Chọn câu trả lời đúng và ghi vào bài làm của em.
Câu 1. Cặp chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm?
A. KMnO4, KClO3 B. H2O, KClO3 C. K2MnO4, KClO3 D.KMnO4, H2O
Câu 2. Oxi phản ứng với nhóm chất nào dưới đây ?
A. C, Cl2, Na B. S, C4H10, Fe C. Na, C4H10, P2O5 D. Au, N2, H2O
Câu 3. Hiđro thu được bằng cách đẩy nước vì:
A.Hiđro có tính khử B.Khí hi đro nhẹ hơn nước
C.Là khí nhẹ nhất trong các chất khí. D.Khí hiđro ít tan trong nước
Câu 4. Cho 200 ml dung dịch HCl có hòa tan 13,5 gam Al . Nồng độ mol của dung dịch HCl tham gia là:
A. 0,5 M B. 0,15 M C. 0,75 M D. 0,2 M
Câu 5. Nhóm chất nào sau đây tác dụng với nước tạo thành dung dịch làm quỳ tím chuyển sang màu xanh?
Na, CaO, K B. Ca, CuO, Ba C. K, H3PO4, Ca D. Ca(OH)2, Na, CH4
Câu 6. Khối lượng nước cần pha 50 gam dung dịch CuSO4 có nồng độ 10% là:
5 gam B. 45g C. 50g D. 160g
Câu 7: Hãy ghép mỗi nội dung thí nghiệm ở cột A với hiện tượng xảy ra ở cột B cho phù hợp
| Cột A | Cột B |
|---|---|
| 1.Lưu huỳnh cháy trong không khí | a. cháy mạnh, sáng chói, không có ngọn lửa, không khói. |
| 2. Sắt cháy trong lọ khí oxi | b. không làm cho than hồng bùng cháy |
| 3. Đốt khí hiđro bằng que đóm còn tàn đỏ | c. với ngọn lửa nhỏ, màu xanh nhạt, mùi sốc |
| 4. Cho mẫu Na vào cốc nước | d. dung dịch thu được làm quỳ tím hóa đỏ |
e. phản ứng tỏa nhiệt, có khí thoát ra, dung dịch làm quỳ tím hóa xanh. |
II. PHẦN TỰ LUẬN (6,0 điểm).
Câu 1. (2,0 điểm) Cho các công thức hóa học sau: K2O, CuO, CO3, Mg2O, P5O2,Fe3O2. Công
thức nào sai, sửa lại cho đúng. Phân loại các oxit và đọc tên các chất.
Câu 2. (1,5 điểm) Hoàn thành dãy chuyển hóa sau và cho biết mỗi phản ứng thuộc loại phản ứng nào ?
KClO3 O2 CuO H2O H3PO4
(5)
H2O  Ca(OH)2
Ca(OH)2
Câu 3. (2,5 điểm) Cho 11,2 gam Fe tác dụng với 100 ml dung dịch HCl 0,5M.
a. Chất nào dư sau phản ứng và khối lượng dư bao nhiêu?
b. Tính thể tích khí H2 tạo thành ở điều kiện tiêu chuẩn.
c. Tính nồng độ mol các chất sau phản ứng.
( Cho biết Fe= 56, H=1, Cl=35,5)
Mã đề 06
I. PHẦN TRẮC NGHIỆM (4,0 điểm). Chọn câu trả lời đúng nhất trong các câu hỏi sau:
Câu 1. Cặp chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm?
A. K2MnO4, KClO3 B. H2O, KClO3 C. KMnO4, KClO3 D.KMnO4, H2O
Câu 2. Oxi phản ứng với nhóm chất nào dưới đây ?
A. C, Cl2, Na B. S, C4H10, Fe C. Na, C4H10, P2O5 D. KMnO4, N2, H2O
Câu 3. Hiđro thu được bằng cách đẩy không khí và úp ngược ống nghiệm vì:
A.Hiđro có tính khử B.Khí hi đro nhẹ hơn nước
C.Là khí nhẹ nhất trong các chất khí. D.Khí hiđro ít tan trong nước
Câu 4. Cho 500 ml dung dịch HCl có hòa tan 13,5 gam Al . Nồng độ mol của dung dịch HCl tham gia là:
A. 0,5 M B. 1,5 M C. 0,3 M D. 3 M
Câu 5. Nhóm chất nào sau đây tác dụng với nước tạo thành dung dịch làm quỳ tím chuyển sang màu đỏ?
Na, CaO, K B. CO2, P2O5, SO2 C. K, H3PO4, Ca D. Ca(OH)2, Na, SO3
Câu 6. Khối lượng nước cần pha 50 gam dung dịch NaOH có nồng độ 20% là:
100 gam B. 10g C. 40g D. 50g
Câu 7. Hãy ghép mỗi nội dung thí nghiệm ở cột A với hiện tượng xảy ra ở cột B cho phù hợp
| Cột A | Cột B |
|---|---|
| 1.Đốt bột CuO với H2 ở nhiệt độ cao | a. cháy mạnh, sáng chói, không có ngọn lửa, không khói. |
| 2. Sắt cháy trong lọ khí oxi | b. cháy với ngọn lửa xanh |
| 3. Đốt khí hiđro bằng ngọn lửa đang cháy | c. tạo chất rắn màu đỏ và hơi nước |
| 4. Cho mẫu Na vào cốc nước | d. dung dịch thu được làm quỳ tím hóa đỏ |
e. phản ứng tỏa nhiệt, có khí thoát ra, dung dịch làm quỳ tím hóa xanh. |
II. PHẦN TỰ LUẬN (6,0 điểm).
Câu 1. (2,0 điểm) Cho các công thức hóa học sau: Na2O, CuO2, CO3, Mg2O, S5O2,Fe3O2. Công
thức nào sai, sửa lại cho đúng. Phân loại các oxit và đọc tên các chất.
Câu 2. (1,5 điểm) Hoàn thành dãy chuyển hóa sau và cho biết mỗi phản ứng thuộc loại phản ứng nào ?
KMnO4 O2 PbO H2O H2SO4
(5)
H2O Ca(OH)2
Câu 3. (2,5 điểm) Cho a gam kim loại Zn tác dụng với 400 ml dung dịch HCl thu được 2,24 lít khí hidro ( ở đktc) và muối kẽm clorua.
Viết PTHH xảy ra.
Tính khối lượng kẽm tham gia phản ứng
Tính nồng độ mol/lít của dung dịch HCl đã tham gia phản ứng.
Dùng 0,8 gam khí oxi để đốt cháy toàn bộ lượng H2 trên để tạo ra bao nhiêu gam nước ?
( Cho biết Zn= 65, H=1, Cl=35,5, O= 16)
-------------- Hết ----------------
(Giáo viên coi kiểm tra không giải thích gì thêm)