Bài 32. Luyện tập chương III
Bài 32.1 Trang 40 Sách bài tập (SBT) Hóa học 9
Ngâm hỗn hợp các kim loại Al, Cu, Fe trong mỗi dung dịch sau :
a) Dung dịch CuS04 (dư).
b) Dung dịch AgN03 (dư).
c) Dung dịch FeS04 (dư).
Viết các phương trình hoá học. Kim loại nào thu được trong mỗi trường hợp ?
Hướng dẫn giải
- Kim loại Cu thu được sau khi ngâm hỗn hợp các kim loại Al, Cu, Fe vào dung dịch CuSO4 dư
2Al + 3CuS04 --------> Al2(S04)3 + 3Cu
Fe + CuSO4 ------- > FeS04 + Cu
- Kim loại Ag thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch AgN03 dư :
Al + 3AgN03 —----> Al(N03)3 + 3Ag
Fe + 2AgN03 -------> Fe(N03)2 + 2Ag
Cu + 2AgN03 —-----> Cu(N03)2 + 2Ag
- Kim loại Fe và Cu thu được sau khi ngâm hỗn hợp các kim loại AI, Cu, Fe vào dung dịch FeS04 dư :
2Al + 3FeS04 -------> Al2(S04)3 + 3Fe
Bài 32.2 Trang 40 Sách bài tập (SBT) Hóa học 9
Khi cho khí clo tác dụng với kim loại, em có nhận xét gì về mức độ hoạt động hoá học của nguyên tố clo. Cho thí dụ minh hoạ.
Hướng dẫn giải
Khí clo phản ứng trực tiếp với hầu hết các kim loại, phản ứng xảy ra nhanh và toả nhiêt.
Thí dụ : - Natri kim loại nóng chảy cháy trong khí clo với ngọn lửa sáng chói và ở thành bình xuất hiện lớp natri clorua màu trắng.
- Đồng, sắt, thiếc và nhiều kim loại khác cháy trong clo cho muối clorua tương ứng.
Bài 32.3 Trang 40 Sách bài tập (SBT) Hóa học 9
Có bốn mẫu khí A, B, C, D đựng riêng biệt trong các bình thủy tinh. Mỗi khí có một số tính chất trong các tính chất sau:
A. Cháy trong không khí tạo ra chất lỏng không màu (ở nhiệt độ thường), chất lỏng này làm cho đồng(II) sunfat khan màu trắng chuyển thành màu xanh.
B. Độc, cháy với ngọn lửa màu xanh, sinh ra chất khí làm đục nước vôi trong.
C. Không cháy nhưng làm cho ngọn lửa cháy sáng chói hơn.
D. Không cháy mà còn làm tắt ngọn lửa và làm quỳ tím ẩm hoá đỏ.
Khí nào nói trên là : hiđro ; oxi ; cacbon đioxit; cacbon oxit ?
Hướng dẫn giải
A : Khí H2 ; C : Khí 02 ;
B : Khí CO ; D : Khí C02.
Bài 32.4 Trang 40 Sách bài tập (SBT) Hóa học 9
Cặp nguyên tố nào sau đây dễ kết hợp với nhau để tạo thành một hợp chất ổn định ?
a) Zn, Ne ; b) H, S ; c) Br, Be ; d) O, Na ; e) K, Kr.
Hướng dẫn giải
Những cặp nguyên tố dễ kết hợp với nhau để tạo thành hợp chất ổn định :
b) H, S cho hợp chất H2S ; c) Br, Be cho hợp chất BeBr2 ;
d) O, Na cho hợp chất Na2O
Bài 32.5 Trang 41 Sách bài tập (SBT) Hóa học 9
Có 4 lá kim loại: sắt, đồng, nhôm, bạc. Làm thế nào để có thể nhận biết được mỗi kim loại bằng phương pháp hoá học. Viết các phương trình hoá học.
Hướng dẫn giải
- Kim loại nào tan trong dung dịch NaOH đặc tạo bọt khí bay ra là Al.
- Ba kim loại còn lại, kim loại nào tan trong dung dịch HCl và tạo bọt khí bay lên là Fe.
- Hai kim loại còn lại, kim loại nào đẩy được bạc ra khỏi dung dịch AgNO3 là Cu.
- Kim loại còn lại là Ag (không phản ứng với dung dịch AgN03).
Bài 32.6 Trang 41 Sách bài tập (SBT) Hóa học 9
Trong phòng thí nghiệm có 3 lọ mất nhãn đựng ba chất bột trắng là : BaC03, NaCl, Na2C03. Làm thế nào để nhận ra hoá chất trong mỗi lọ với điều kiện chỉ dùng thêm dung dịch HCl loãng ?
Hướng dẫn giải
- Lần lượt cho 3 chất vào 3 ống nghiệm đựng dung dịch HCl, nếu chất nào tan và có khí bay ra là Na2C03, BaC03 và chất nào tan mà không có khí bay ra là NaCl.
Na2C03 + 2HCl —> 2NaCl + C02 + H20 (1)
BaCO3 + 2HCl —> BaCl2 + C02 + H20 (2)
- Sau đó hoà tan một ít Na2C03 và BaC03 vào nước. Chất nào tan trong nước là Na2C03
Chất không tan trong nước là BaC03.
Bài 32.7 Trang 41 Sách bài tập (SBT) Hóa học 9
Hình vẽ 3.5 là thiết bị điều chế khí clo trong phòng thí nghiệm.
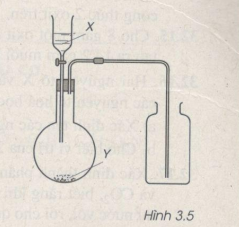
a) X và Y là những chất nào trong số các chất sau ?
X : H2O, dd HCl, dd H2SO4, dd NaOH, dd NaCl.
Y : NaCl, CaCO3, MnO2, CuCl2, Na2S04, KMn04.
Viết phương trình hoá học điều chế khí clo từ những chất đã chọn ở trên.
Hướng dẫn giải
a) X là : dd HC
Y là : MnO2, KMnO4
b) Phương trình hoá học của phản ứng điều chế clo.
Bài 32.8 Trang 41 Sách bài tập (SBT) Hóa học 9
Một nguyên tố X tạo được các hợp chất sau : XH3, X205. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X cùng nhóm với
A. agon ; B. nitơ ;
C. oxi ; D. flo.
Hướng dẫn giải
Đáp án B.
Bài 32.9 Trang 41 Sách bài tập (SBT) Hóa học 9
Cho kim loại Al có dư vào 400 ml dung dịch HCl 1M. Dẫn khí tạo ra qua ống đựng CuO dư, nung nóng thì thu được 11,52 gam Cu. Tính hiệu suất của quá trình phản ứng.
Hướng dẫn giải
Theo (1) và (2) ta có sơ đồ chuyển hóa:
6 mol HCl ---> 3 mol ---> 3 mol Cu
0,4 mol HCl x mol Cu
Bài 32.10 Trang 41 Sách Bài tập (SBT) Hóa học 9
Nung hỗn hợp CaC03 và MgC03 thu được 76 gam hai oxit và 33,6 lít CO2 (đktc). Tính khối lượng của hỗn hợp ban đầu.
Hướng dẫn giải
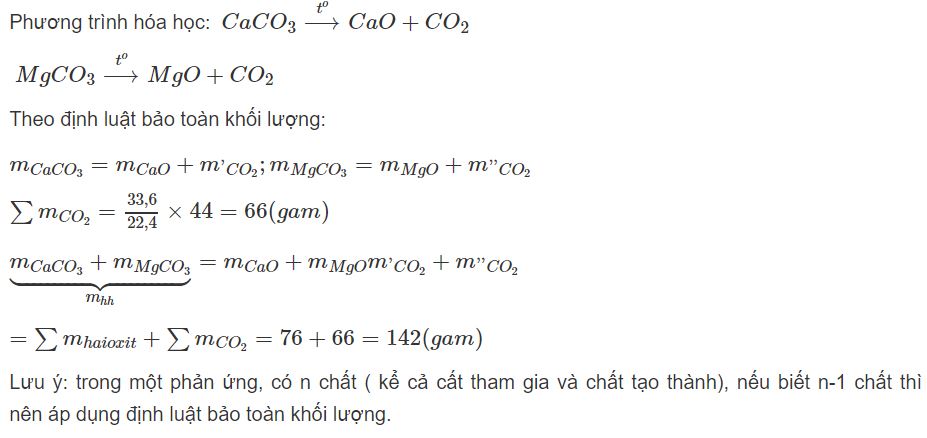
Bài 32.11* Trang 41 Sách bài tập (SBT) Hóa học 9
Có hai lá kẽm khối lượng như nhau. Một lá cho vào dung dịch đồng(II) nitrat, lá kia cho vào dung dịch chì(II) nitrat. Sau cùng một thời gian phản ứng, khối lượng lá kẽm thứ nhất giảm 0,05 gam.
a) Viết các phương trình hoá học.
b) Khối lượng lá kẽm thứ 2 tăng hay giảm là bao nhiêu gam ? Biết rằng trong cả 2 phản ứng trên, khối lượng kẽm bị hoà tan bằng nhau.
Hướng dẫn giải
Zn
x mol x mol
Theo đầu bài ta có : 65x - 64x = 0,05
=> x = 0,05 (mol) ; mZn = 0,05 x 65 = 3,25 (gam).
Zn + Pb(N03)2 ----------> Zn(N03)2 + Pb
0,05 mol 0,05 mol
Khối lượng lá kẽm thứ 2 tăng: ( 0,05 x 207) - 3,25 = 7,1 (gam).
Bài 32.12 Trang 41 Sách bài tập (SBT) Hóa học 9
Cho hỗn hợp 2 kim loại Fe và Cu tác dụng với khí clo dư thu được 59,5 gam hỗn hợp muối. Cũng lượng hỗn hợp trên cho tác dụng với lượng dư dung dịch HCl 10% thu được 25,4 gam một muối.
a) Tính phần trăm khối lượng mỗi muối trong hỗn hợp muối thu được.
b) Tính thể tích dung dịch HCl 10% (D = 1,0 g/ml) cần dùng.
Hướng dẫn giải
x mol x mol
y mol y mol
x mol 2x mol x mol
Theo đề bài và phương trình hóa học trên ta có:
127x = 25,4 => 0,2 mol
162,5x + 135y = 59,5. Thay x= 0,2 vào phương trình, ta có:
32,5 + 135y = 59,5 => y = 0,2
Tính % khối lượng mỗi muối (học sinh tự tính).
b) maxit cần dùng =0,2 x 2 x 36,5 = 14,6(gam)
mdung dịch HCl =146(gam) =>
Bài 32.13 Trang 42 Sách bài tập (SBT) Hóa học 9
Cho 23,6 gam hỗn hợp gồm Mg, Fe, Cu tác dụng vừa hết với 91,25 gam dung dịch HCl 20% thu được dung dịch A và 12,8 gam chất không tan.
Tính khối lượng các kim loại trong hỗn hợp ban đầu.
Hướng dẫn giải
Hướng dẫn giải. Cu không tác dụng với dung dịch HCl nên 12,8 gam là khối lượng của Cu.
Phương trình hóa học:
x mol 2x mol
y mol 2y mol
Ta có các phương trình:
24x + 56y = 23,6 - 12,8 = 10,8 (I)
2x + 2y = 0,5 (II)
Giải phương trình (I), (II) ta tìm được x và y:
Bài 32.14 Trang 42 Sách bài tập (SBT) Hóa học 9
Nguyên tố A tạo được 2 loại oxit. Phần trăm về khối lượng của oxi trong 2 oxit lần lượt bằng 50% và 60%. Xác định nguyên tử khối của A và cho biết công thức 2 oxit trên.
Hướng dẫn giải
Gọi công thức 2 oxit là A2Ox và A2Oy, đồng thời kí hiệu A là nguyên tử khối. Ta có tỉ lệ khối lượng oxi trong 2 oxit là : 50% và 60%. Vậy tỉ lệ khối lượng A trong 2 oxit là 50% và 40%.
Chỉ có các cặp x, y sau có thể chấp nhận :
- Nếu chọn x = 2 —> ta có 32 = 2A —> A = 16 (loại) vì A = 16 là oxi.
- Nếu chọn x = 4 —> ta có 64 = 2A —> A = 32 —> A là lưu huỳnh (S).
Tỉ lệ giữa các nguyên tố là tối giản, ta có hai oxit là : SO2 và SO3
Bài 32.15 Trang 42 Sách bài tập (SBT) Hóa học 9
Cho 8 gam một oxit (có công thức X03) tác dụng với dung dịch NaOH dư tạo ra 14,2 gam muối khan.Tính nguyên tử khối của X.
Hướng dẫn giải
Gọi nguyên tử khối của nguyên tố X cũng là X.
Phương trình hoá học :
XO3 + 2NaOH -------> Na2X04 + H2O
(X + 48) gam (46 + X + 64) gam
8 gam 14,2 gam
8(46 +X + 64)= 14,2(X + 48)
Giải ra ta có X = 32. Nguyên tố X là lưu huỳnh (S).
Bài 32.16 Trang 42 Sách bài tập (SBT) Hóa học 9
Hai nguyên tố X và Y ở hai chu kì kế tiếp nhau trong bảng tuần hoàn các nguyên tố hoá học và có tổng số điện tích hạt nhân là 16.
a) Xác định tên các nguyên tố X và Y
b) Cho biết vị trí của 2 nguyên tố trong bảng tuần hoàn.
Hướng dẫn giải
a) Tên nguyên tố X là magie, nguyên tố Y là beri.
b) Nguyên tố Mg ở chu kì 3 nhóm IIA.
Nguyên tố Be ở chu kì 2 nhóm IIA.
Bài 32.17 Trang 42 Sách bài tập (SBT) Hóa học 9
Xác định thành phần phần trăm (về thể tích) của hỗn hợp khí gồm N2, CO và C02, biết rằng khi cho 10,0 lít (ở đktc) hỗn hợp khí đó đi qua một lượng dư nước vôi, rồi cho qua đồng(II) oxit dư đốt nóng thì thu được 5 gam kết tủa và 3,2 gam đồng.
Nếu cũng lấy 10,0 lít (ở đktc) hỗn hợp khí đó cho đi qua ống đồng(II) oxit dư đốt nóng, rồi đi qua một lượng dư nước vôi trong thì thu được bao nhiêu gam kết tủa ?
Hướng dẫn giải
Phương trình hóa học của phản ứng:
(1)
0,05 mol
(2)
0,05 mol 0,05 mol
Như vậy:
Nếu cho phản ứng (2) thực hiện trước rồi mới đến phản ứng (1) thì
Vậy
Bài 32.18 Trang 42 Sách bài tập (SBT) Hóa học 9
Hoà tan 10 gam hỗn hợp 2 muối cacbonat của kịm loại hoá trị II và III bằng dung dịch HCl, ta thu được dung dịch X và 0,672 lít khí bay ra (ở đktc). Tính khối lượng muối thu được khi cô cạn dung dịch X.
Hướng dẫn giải
Cách 1 : Viết phương trình hoá học của XCO3 và Y2(CO3)3 với dung dịch HCl và rút ra nhận xét :
Áp dụng định luật bảo toàn khối lượng, ta có :
m2 muối cacbonat + maxit = m2 muối clorua + mCO2 + mH20
m2 muối clorua = 10 + (0,03 x 2 x 36,5) - (0,03 x 44) - (0,03 x 18) = 10,33 (gam)
Cách 2 : Áp dụng phương pháp tăng giảm khối lượng
Viết phương trình hoá học của XCO3 và Y2(C03)3 với dung dịch HCl, ta nhận thấy khi chuyển từ muối cacbonat thành muối clorua thì cứ 1 mol CO2 bay ra thì khối lượng tăng : 71 - 60 = 11 (gam)
0,03 mol CO2 bay ra thì khối lượng tăng : 0,03 x 11 gam
Tổng khối lượng muối clorua tạo thành : 10 + (0,03 x 11)= 10,33 (gam)
Bài 32.19 Trang 42 Sách bài tập (SBT) Hóa học 9
Thể tích khí clo cần phản ứng với kim loại M bằng 1,5 lần lượng khí sinh ra khi cho cùng lượng kim loại đó tác dụng hoàn toàn với dung dịch axit HCl dư trong cùng điều kiện. Khối lượng muối clorua sinh ra trong phản ứng với clo gấp 1,2886 lần lượng sinh ra trong phản ứng với axit HCl. Xác định kim loại M
Hướng dẫn giải
Phương trình hóa học của phản ứng:
Theo đề bài, ta có:
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)
Bài 32.20 Trang 42 Sách bài tập (SBT) Hóa học 9
X, Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A phải dùng 150 ml dung dịch AgNO3 0,2M. Xác định hai nguyên tố X và Y.
Hướng dẫn giải
NaX + AgN03 ----> NaN03 + AgX
a mol a mol a mol a mol
NaY + AgN03 -----> NaN03+ AgY
b mol b moi b mol b mol
Áp dụng định luật bảo toàn khối lượng, ta có :
2,2 + 5,1 = 2,55 + mkết tủa ---> mkết tủa = 4,75 (gam)
(108 + X)a + (108 + Y)b = 4,75 ; a + b = 0,03 (mol)
Xa + Yb + 15,1. Cho X > Y ; Xa + Xb > Xa + Yb > Ya + Yb
XY→XY
X và Y là các halogen liên tiếp, vậy đó là brom (80) và Cl (35,5).
Bài 32.21 Trang 42 Sách bài tập (SBT) Hóa học 9
Cho 8,3 gam hỗn hợp hai kim loại đệu có hoá trị III là X và Y (có tỉ lệ số mol là 1:1) tác dụng vừa đủ với 6,72 lít khí clo. Sau đó hoà tan toàn bộ muối tạo ra trong nước (dư) được 250 ml dung dịch. Xác định hai kim loại và nồng độ mol mỗi muối trong dung dịch thu được.
Hướng dẫn giải
Kí hiệu X,Y cũng là nguyên tử khối của 2 kim loại, số mol của 2 kim loại là a
a mol 3a/2 mol a mol
a mol 3a/2 mol a mol
Theo phương trình hóa học trên và dữ liệu đề bài, ta có :
\({{3a} \over 2} + {{3a} \over 2} = {{6,72} \over {22,4}} = 0,3(mol) \to a = 0,1(mol)\)
Xa + Ya = 8,3 —> 0,1(X + Y) = 8,3 —> X + Y = 83
Vậy X = 56 (Fe) và Y = 27 (Al)
\({C_{M(AlC{l_3})}} = {C_{M(FeC{l_3})}} = {{0,1} \over {0,25}} = 0,4(M)\)
Bài 32.22 Trang 42 Sách bài tập (SBT) Hóa học 9
Đem nung 6,7 gam hỗn hợp 2 muối CaC03 và XCO3 có tỉ lệ số mol là 1:2 đến khối lượng không đổi, thấy khối lượng chất rắn giảm đi 3,3 gam. Dẫn toàn bộ lượng khí sinh ra qua bình đựng 2,5 lít dung dịch nước vôi trong 0,02M.
a) Xác định kim loại X
b) Tính nồng độ mol của các chất trong dung dịch khi cho C02 vào nước vôi trong.
Hướng dẫn giải





