Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
Bài 1.1 Trang 3 Sách bài tập (SBT) Hóa học 9
Có những oxit sau : H2O, SO2, CuO, CO2, CaO, MgO. Hãy cho biết những chất nào có thể điều chế bằng
a) phản ứng hoá hợp ? Viết phương trình hoá học.
b) phản ứng phân huỷ ? Viết phương trình hoá học
Hướng dẫn giải
a) Điều chế bằng phương pháp hoá hợp : H2O, SO2, CuO, CO2, CaO, MgO.
\( 2{H_2} + {O_2} \to 2{H_2}O \\ S + {O_2} \to S{O_2} \\ 2Cu + {O_2} \to 2CuO \\ C + {O_2} \to C{O_2} \\ 2Ca + {O_2} \to 2CaO \\ 2Mg + {O_2} \to 2MgO \)
b) Điều chế bằng phương pháp phân huỷ : CuO, CO2, CaO, MgO.
Thí dụ :
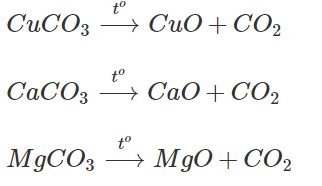
Bài 1.2 Trang 3 Sách bài tập (SBT) Hóa học 9
Hãy viết công thức hoá học và tên gọi của
a) 5 oxit bazơ ;
b) 5 oxit axit.
Hướng dẫn giải
a) Các oxit bazơ: đồng(II) oxit : CuO, natri oxit : Na2O, canxi oxit : CaO, sắt(III) oxit: Fe2O3 ...
b) Các oxit axit: cacbon đioxit (CO2), lưu huỳnh đioxit (SO2), đinitơ pentaoxit (N2O5) …
Bài 1.3 Trang 3 Sách bài tập (SBT) Hóa học 9
Khí cacbon monooxit (CO) có lẫn các tạp chất là khí cacbon đioxit (CO2) và lưu huỳnh đioxit (SO2) Làm thế nào tách được những tạp chất ra khỏi CO ? Viết các phương trình hoá học.
Hướng dẫn giải
Dẫn hỗn hợp khí qua dung dịch bazơ dư, các tạp chất là oxit axit bị giữ lại. Đi ra khỏi dung dịch là khí CO (oxit trung tính không tác dụng với bazơ).
Phương trình phản ứng
\(C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O\)
Bài 1.4 Trang 3 Sách bài tập (SBT) Hóa học 9
Hãy tìm công thức hoá học của những oxit có thành phần khối lượng như sau :
a) S : 50% ; b) C : 42,8% ; c) Mn : 49,6% ; d) Pb : 86,6%.
Hướng dẫn giải
a) Phần trăm khối lượng của O là: 100% - 50% = 50%
Đặt công thức hoá học của oxit lưu huỳnh là SxOy, ta có :
\(x:y = \dfrac{{50}}{{32}}:\dfrac{{50}}{{16}} = 1:2\)
Oxit của lưu huỳnh có công thức hoá học là SO2.
b) Phần trăm khối lượng của O là: 100% - 42,8% = 57,2%
Đặt công thức hóa học của cacbon oxit là: \(C_xO_y\) ta có:
\(x:y = \dfrac{{42,8}}{{12}}:\dfrac{{57,2}}{{16}} = 1:1\)
Vậy công thức hóa học cần tìm là CO
c) Phần trăm khối lượng của O là: 100% - 49,6% = 50,4%
Đặt công thức hóa học cần tìm là \(Mn_xO_y\)
\(x:y = \dfrac{{49,6}}{{55}}:\dfrac{{50,4}}{{16}} = 2:7\)
Vậy công thức hóa học cần tìm là: \(Mn_2O_7\)
d) Phần trăm khối lượng của O là: 100% - 86,6% = 13,4%
Đặt công thức hóa học cần tìm là \(Pb_xO_y\)
\(x:y = \dfrac{{86,6}}{{207}}:\dfrac{{13,4}}{{16}} = 1:2\)
Vậy công thức cần tìm là: PbO2
Bài 1.5 Trang 3 Sách bài tập (SBT) Hóa học 9
Biết rằng 1,12 lít khí cacbon đioxit (đktc) tác dụng vừa đủ với 100 ml dung dịch NaOH tạo ra muối trung hoà.
a) Viết phương trình hoá học.
b) Tính nồng độ mol của dung dịch NaOH đã dùng.
Hướng dẫn giải
a) \(C{O_2} + 2NaOH \to N{a_2}C{O_3} + {H_2}O\)
b)
\( C{O_2}\,\,\,\, + \,\,\,2NaOH \to N{a_2}C{O_3} + {H_2}O \\ 1\,mol \to \,2mol \)
\({n_{NaOH}} = 2{n_{C{O_2}}} = \dfrac{{1,12 \times 2} }{{22,4}} = 0,1(mol)\)
Nồng độ mol của dung dịch NaOH là:
\(C{M_{NaOH}} = \dfrac{{0,1}}{{0,1}} = 1\,M\)
Bài 1.6 Trang 4 Sách bài tập (SBT) Hóa học 9
Cho 15,3 gam oxit của kim loại hoá trị II vào nước thu được 200 gam dung dịch bazơ với nồng độ 8,55%. Hãy xác định công thức của oxit trên.
Hướng dẫn giải
Cách 1 .
Đặt công thức hoá học của oxit là MO => công thức bazơ là M(OH)2
\({M_{M{{\left( {OH} \right)}_2}}} = M + \left( {16 + 1} \right).2 = M + 34\) (g/mol)
Ta có \({m_{M{{(OH)}_2}}} = {{8,55 \times 200} \over {100}} = 1,71(gam)\)
\( MO + {H_2}O \to M{\left( {OH} \right)_2} \\ \,\,1\,mol\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,1\,mol \)
Từ phương trình ta có: \({n_{MO}} = {n_{M{{\left( {OH} \right)}_2}}}\)
\(\to {{15,3} \over {M + 16}} = {{17,1} \over {M + 34}} \to M = 137\)
Vậy công thức oxit là BaO.
Cách 2 :
Theo định luật bảo toàn khối lượng ta có:
\({m_{{H_2}O\text{(phản ứng)}}} = {m_{M{{(OH)}_2}}} - {m_{MO}} = 17,1 - 15,3 = 1,8(gam)\)
\( MO \;\;+ \;\;{H_2}O \to M{\left( {OH} \right)_2} \\ 1\,mol\to \,1\,mol \)
Từ phương trình ta có:
\({n_{MO}} = {n_{{H_2}O}} = {{1,8} \over {18}} = 0,1(mol) \)
\(\to M + 16 = {{15,3} \over {0,1}} = 153 \to M = 137\)
Vậy công thức oxit là BaO
Bài 1.7 Trang 4 Sách bài tập (SBT) Hóa học 9
Cho 38,4 gam một oxit axit của phi kim X có hoá trị IV tác dụng vừa đủ với dung dịch NaOH thu được 400 gam dung dịch muối nồng độ 18,9%. Xác định công thức của oxit.
Hướng dẫn giải
Cách 1 : Đặt công thức của oxit là XO2. \({m_{muoi}} = {{18,9 \times 400} \over {100}} = 75,6(gam)\)
\(X{O_2} + 2NaOH \to N{a_2}X{O_3} + {H_2}O\)
Theo phương trình hoá học \({n_{X{O_2}}} = {n_{N{a_2}X{O_3}}} \to {{38,4} \over {X + 32}} = {{75,6} \over {46 + X + 48}}\)
=> X = 32 => Công thức oxit là SO2.
Cách 2: \({m_{muoi}} = 75,6(gam) \to {m_{N{a_2}O}} = 75,6 - 38,4 = 37,2(gam)\)
\( \to {n_{N{a_2}O}} = {{37,2} \over {62}} = 0,6(mol)\)
\( \to {n_{X{O_2}}} = {n_{N{a_2}O}} = 0,6(mol) \to {M_{X{O_2}}} = {{38,4} \over {0,6}} = 64(gam/mol) \to X = 32\)
=> Công thức oxit là SO2.




