BÀI 24. Tính chất của oxi
Bài 24.1 Trang 32 Sách bài tập (SBT) Hóa học 8
Phát biểu nào sau đây đúng ?
A.Oxi là chất khí tan ít trong nước và nhẹ hơn không khí.
B.Oxi là chất khí tan vô hạn trong nước và nặng hơn không khí.
C Khí oxi dễ dàng tác dụng được với nhiều đơn chất (kim loại, phi kim) và hợp chất.
D. Ở nhiệt độ cao, khí oxi dễ dàng tác dụng được với nhiều đơn chất (kim loại, phi kim) và hợp chất.
Hướng dẫn giải
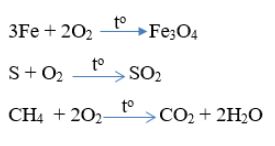
Chọn D
PTHH:
Bài 24.2 Trang 32 Sách bài tập (SBT) Hóa học 8
Viết các phương trình hoá học của phản ứng giữa O2 với :
a) 3 kim loại hoá trị I, II, IU.
b) 3 phi kim, thí dụ như C, S, P...
c) 3 hợp chất, thí dụ như :
- khí ga (butan C4H10) sinh ra cacbon đioxit và nước.
-khí amoniac (NH3) sinh ra khí nitơ và nước.
-khí hiđro suníua (H2S) sinh ra khí suníurơ và nước.
Hướng dẫn giải
Phương trình hóa học của phản ứng giữa O2 với:
a) 3 kim loại : \(4Na + {O_2}\buildrel {{t^o}} \over\longrightarrow 2N{a_2}O\)
\(2Mg + {O_2}\buildrel {{t^o}} \over\longrightarrow 2MgO\)
\(4Al + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2A{l_2}{O_3}\)
b) 3 phi kim: \(C + {O_2}\buildrel {{t^o}} \over\longrightarrow C{O_2}\)
\(S + {O_2}\buildrel {{t^o}} \over\longrightarrow S{O_2}\)
\(4P + 5{O_2}\buildrel {{t^o}} \over\longrightarrow 2{P_2}{O_5}\)
c) 3 hợp chất: \(2{C_4}{H_{10}} + 13{O_2}\buildrel {{t^o}} \over\longrightarrow 8C{O_2} + 10{H_2}O\)
\(4N{H_3} + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2{N_2} + 6{H_2}O\)
\(2{H_2}S + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2S{O_2} + 2{H_2}O\)
Bài 24.3 Trang 32 Sách bài tập (SBT) hóa học 8
Oxi trong không khí là đơn chất hay hợp chất ? Vì sao cá sống được trong nước ? Những lĩnh vực hoạt động nào của con người cần thiết phải dùng binh nén oxi để hô hấp ?
Hướng dẫn giải
Oxi trong không khí là đơn chất. Cá sống được trong nước vì trong nước có hoà tan khí oxi. Những lĩnh vực hoạt động của con người cần thiết phải dùng bình nén oxi để hô hấp là : thợ lặn, phi công lái máy bay, phi công vũ trụ, bệnh nhân khó thở, công nhân làm việc ở các hầm mỏ sâu...
Bài 24.4 Trang 32 Sách bài tập (SBT) Hóa học 8
Trong ba bình giống hệt nhau và có chứa thể tích oxi như nhau. Đồng thời ta cho vào 3 bình: bình (1) một cục than đang cháy, bình (2) hai cục than đang cháy, bình (3) ba cục than đang cháy (các cục than có kích thước như nhau).
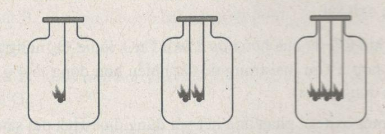
Em hãy nhận xét về hiện tượng xảy ra trong thí nghiệm trên.
Hướng dẫn giải
Ở bình (1) cục than cháy lâu hơn ở binh (2): Bình (2) cục than cháy lâu hơn ở bình (3) vì lượng oxi ở 3 bình như nhau.
Bài 24.5 Trang 33 Sách bài tập (SBT) Hóa học 8
Người và động vật trong quá trình hô hấp hấp thụ O2, thở ra khí CO2. Nhiên liệu xăng, dầu trong quá trình đốt cháy cũng cần O2 và thải ra CO2. Như vậy lượng O2 phải mất dần, nhưng trong thực tế hàng nghìn năm nay, tỉ lệ về thể tích của oxi trong không khí luôn luôn xấp xỉ bằng 20%. Hãy giải thích.
Hướng dẫn giải
Người và động vật trong quá trình hô hấp lấy O2, thải ra khí CO2. Nhiên liệu trong quá trình đốt cháy cũng cần O2 và thải ra CO2, nhưng lượng O2 không mất dần do sự quang hợp của cây xanh đã hấp thụ khí CO2 và tạo ra lượng khí oxi rất lớn. Do đó tỉ lệ oxi trong không khí (tính theo thể tích) luôn luôn xấp xỉ bằng 20%.
Bài 24.6 Trang 33 Sách bài tập (SBT) Hóa học 8
Có những chất sau : O2, Mg, P, Al, Fe
Hãy chọn một trong những chất trên và hệ số thích hợp điền vào chỗ trống trong các phương trình hoá học sau :
\(4Na + ...\buildrel {{t^o}} \over\longrightarrow 2N{a_2}O\)
\(... + {O_2}\buildrel {{t^o}} \over\longrightarrow 2MgO\)
\(... + 5{O_2}\buildrel {{t^o}} \over\longrightarrow 2{P_2}{O_5}\)
\(... + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2A{l_2}{O_3}\)
\(... + ...\buildrel {{t^o}} \over\longrightarrow F{e_3}{O_4}\)
Hướng dẫn giải
\(4Na + {O_2}\buildrel {{t^o}} \over\longrightarrow 2N{a_2}O\)
\(2Mg + {O_2}\buildrel {{t^o}} \over\longrightarrow 2MgO\)
\(4P + 5{O_2}\buildrel {{t^o}} \over\longrightarrow 2{P_2}{O_5}\)
\(4Al + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2A{l_2}{O_3}\)
\(3Fe + 2{O_2}\buildrel {{t^o}} \over\longrightarrow F{e_3}{O_4}\)
Bài 24.7 Trang 33 Sách bài tập (SBT) Hóa học 8
Đổ đầy nước vào hộp các-tông (hộp đựng nước uống Vinamilk) kín, đun hộp đó trên bếp lửa, hộp các-tông không cháy mà nước lại sôi.
a) Ở nhiệt độ nào thì nước sôi ?
b) Trong thời gian nước sôi nhiệt độ có thay đổi không ?
c) Vỏ các-tông cháy ở nhiệt độ trên hay dưới 100°C ? Tại sao ?
d) Điều gì xảy ra nếu như trong hộp không chứa nước ?
Hướng dẫn giải
a) Ở nhiệt độ 100 °c thì nước sôi.
b) Trong thời gian nước sôi, nhiệt độ không thay đổi.
c) Vỏ các-tông không cháy trên bếp lửa khi trong hộp các-tông có đầy nước, khi trong hộp các-tông hết nước, vỏ các-tông sẽ cháy ở nhiệt độ trên 100 °C.
d) Nếu trong hộp các-tông không có nước thì vỏ hộp sẽ cháy khi đun hộp trên bếp lửa.
Bài 24.8 Trang 33 Sách bài tập (SBT) Hóa học 8
Trong giờ học về sự cháy, một em học sinh phát biểu: Cây nến cháy và bóng đèn điện cháy. Phát biểu đó có đúng không ?
Hướng dẫn giải
Phát biểu của em học sinh chỉ đúng câu đầu: Cây nến cháy vì có phản ứng cháy của nến với khí oxi, còn bóng đèn sáng lên không phải là phản ứng I cháy (vì không có khí oxi) mà là dây tóc bóng đèn nóng lên thì phát sáng nhờ nguồn điện.
Bài 24.9 Trang 33 Sách bài tập (SBT) Hóa hóa 8
a) Cần bao nhiêu gam oxi để đốt cháy hoàn toàn 5 mol cacbon ? 5 mol lưu huỳnh?
b) Trong giờ thực hành thí nghiệm, một em học sinh đốt cháy 3,2 g lưu huỳnh trong 1,12 lít oxi (đktc). Vậy theo em lưu huỳnh cháy hết hay còn dư ?
Hướng dẫn giải
a) \(C + {O_2} \to C{O_2}\)
5 mol\( \to \)5 mol
Khối lượng oxi để đốt cháy 5 mol cacbon là : 5x32=160(g).
\(S + {O_2} \to S{O_2}\)
5 mol\( \to \)5 mol
Khối lượng oxi để đốt cháy 5 mol lưu huỳnh là : 5x32=160(g).
b) Số mol lưu huỳnh: \({{3,2} \over {32}} = 0,1(mol)\)
Số mol oxi: \({{1,12} \over {22,4}} = 0,05(mol)\)
\(S + \,\,\,\,\,\,\,{O_2} \to \,\,\,\,\,\,\,S{O_2}\)
1 mol 1mol
0,05mol\( \leftarrow \)o,05mol
Theo phương trình trên ta nhận thấy lưu huỳnh còn dư:
0,1-0,05=0,05(mol)
Bài 24.10 Trang 33 Sách bài tập (SBT) Hóa học 8
Tính thể tích khí oxi và thể tích không khí (đktc) cần thiết để đốt cháy :
a) 1 mol cacbon ; b) 1,5 mol photpho
b) Cho biết oxi chiếm 20% thể tích không khí.
Hướng dẫn giải
a) Phương trình hóa học của phản ứng đốt cháy cacbon:
\(C + \,\,\,\,\,\,\,{O_2} \to \,\,\,\,\,\,\,C{O_2}\)
1 mol \( \to \,\,\) 1mol
Thể tích oxi (đktc) cần dùng để đốt cháy 1 mol C là: 1x22,4=22,4(lít).
Thể tích không khí (đktc) cần dùng để đốt cháy 1 mol C là:
\({{22,4} \over {20}} \times 100 = 112(l)\)
b) Phương trình hóa học của phản ứng đốt cháy photpho:
\(4P\,\,\,\, + \,\,\,\,\,5{O_2} \to 2{P_2}{O_5}\)
4mol 5mol
1,5mol x mol
\(x = {{5 \times 1,5} \over 4} = 1,875(mol)\)
thể tích oxi (đktc) cần dùng để đốt cháy 1,5 mol P là:
1,875 x 22,4 =42 (lít)
Thể tích không khí (đktc) cần dùng để đốt cháy 1,5 mol P là:
\({{42} \over {20}} \times 100 = 210(l)\)
Bài 24.11 Trang 34 Sách bài tập (SBT) Hóa học 8
Tính khối lượng của N/2 nguyên tử oxi, của N/4 phân tử oxi và so sánh hai kết quả này.
Hướng dẫn giải
Khối lượng của N nguyên tử oxi bằng 16 g
Suy ra : Khối lượng của N/2 nguyên tử oxi bằng 8 g
Khối lượng của N ph ần tử oxi bằng 32 g.
Suy ra : khối lượng của N/4 phân tử oxi bằng 8 g.
Hai khối lượng này giống nhau.
Bài 24.12 Trang 34 Sách bài tập (SBT) Hóa học 8
Đốt cháy 1 kg than trong khí oxi, biết trong than có 5% tạp chất không cháy.
a) Tính thể tích oxi (đktc) cần thiết để đốt cháy 1 kg than trên.
b) Tính thể tích khí cacbonic (đktc) sinh ra trong phản ứng.
Hướng dẫn giải
Khối lượng than nguyên chất: \(\dfrac{{1000 \times 95}}{{100}} = 950(g)\)
Số mol than nguyên chất :\({{950} \over {12}}mol\)
\(C\,\,\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,{O_2} \to \,\,\,\,\,C{O_2}\)
1mol 1mol 1 mol
\({{950} \over {12}}mol\)\( \to \) \({{950} \over {12}}mol\) \( \to \) \({{950} \over {12}}mol\)
a) Thể tích oxi (đktc) cần dùng để đốt cháy 1 kg than là:
\(\dfrac{{950}}{{12}} \times 22,4 = 1773,3(l)\)
b) Thể tích khí \(C{O_2}\) (đktc) sinh ra bằng thể tích khí oxi tham gia là \(1773,3\) (lít)
Bài 24.13 Trang 34 Sách bài tập (SBT) Hóa học 8
Người ta dùng đèn xì oxi-axetilen để hàn và cắt kim loại. Phản ứng cháy của axetilen C2H2 trong oxi tạo thành khí cacbonic và hơi nước. Hãy tính thể tích khí oxi (đktc) cần thiết để đốt cháy 1 mol khí axetilen.
Hướng dẫn giải
Phương trình hóa học:
\(2{C_2}{H_2} + 5{O_2} \to 4C{O_2} + 2{H_2}O\)
1mol \(\to \) 2,5mol
Thể tích oxi (đktc) dùng để đốt cháy 1 mol C2H2 là: 2,5 x 22,4 = 56 (lít).
Bài 24.14 Trang 34 Sách bài tập (SBT) Hóa học 8
Hãy cho biết 1,5.1024 phân tử oxi:
a) Là bao nhiêu mol phân tử oxi.
b) Có khối lượng là bao nhiêu gam.
c) Có thể tích là bao nhiêu lít (đktc).
Hướng dẫn giải
a) Số mol phân tử oxi: \({{1,{{5.10}^{24}}} \over {{{6.10}^{23}}}} = 2,5(mol)\)
b) Khối lượng của \(1,{5.10^{24}}\) phân tử oxi : 2,5 x 32 = 80 (g)
c) Thể tích (đktc) của \(1,{5.10^{24}}\) phân tử oxi : 2,5 x 22,4 = 56 (lít).
Bài 24.15 Trang 34 Sách bài tập (SBT) Hóa học 8
a) Trong 16 g khí oxi có bao nhiêu mol nguyên tử oxi và bao nhiêu mol phân tử oxi ?
b) Tính tỉ khối của oxi với nitơ, với không khí.
Hướng dẫn giải
a) Trong 16g khí oxi có 1 mol nguyên tử oxi và 0,5 mol phân tử oxi \(\left( {{{16} \over {32}} = 0,5mol} \right)\)
b) Tỷ khối của oxi với nito: \({d_{{O_2}/{N_2}}} = {{{M_{{O_2}}}} \over {{M_{{N_2}}}}} = {{32} \over {18}} \approx 1,14\)
Tỷ khối của oxi với không khí : \({d_{{O_2}/KK}} = {{{M_{{O_2}}}} \over {29}} = {{32} \over {29}} \approx 1,10\)
Bài 24.16 Trang 34 Sách bài tập (SBT) Hóa học 8
Cho 3,36 lít oxi (ở đktc) phản ứng hoàn toàn với một kim loại hoá trị III thu được 10,2 g oxit. Xác định tên kim loại.
Hướng dẫn giải
Gọi R là kí hiệu và nguyên tử khối của kim loại hóa trị III .
\({n_{{O_2}}} = {{3,36} \over {22,4}} = 0,15(mol)\)
Phương trình hóa học của phản ứng ;
\(4R + 3{O_2} \to 2{R_2}{O_3}\)
3 mol (4R + 6 x 16) g
0,15mol 10,2 g
Theo phương trình hóa học trên, ta có :
0,15 x (4R + 6 x 16)= 10,2 x 3
0,6R + 14,4 = 30,6
R=27 (Al)
Bài 24.17 Trang 34 Sách bài tập (SBT) Hóa học 8
Để đốt cháy 1 mol chất X cần 6,5 mol O2, thu được 4 mol khí cacbonic và 5 mol nước. Xác định công thức phân tử của X.
Hướng dẫn giải
Theo đề bài ta có phương trình hóa học :
\(X + 6,5{O_2} \to 4C{O_2} + 5{H_2}O\)
Theo định luật bảo toàn khối lượng thì 1 mol chất X phải có 4 mol C, 10 mol H và không chứa oxi (vì ở vế phải và trái số mol nguyên tử oxi bằng nhau). Vậy công thức phân tử của X là \({C_4}{H_{10}}\)
Bài 24.18 Trang 34 Sách bài tập (SBT) Hóa học 8
Đốt cháy hoàn toàn 6,2 g photpho trong bình chứa 8,96 lít khí oxi (ở đktc), sản phẩm thu được là chất rắn, màu trắng. Nếu hiệu suất phản ứng là 80% thì khối lượng chất rắn thu được là bao nhiêu ?
Hướng dẫn giải
\({n_P} = {{6,2} \over {31}} = 0,2(mol);{n_{{O_2}}} = {{8,96} \over {22,4}} = 0,4(mol)\)
Phương trình hóa học của phản ứng :
\(4P = 5{O_2} \to 2{P_2}{O_5}\)
So sánh tỉ lệ: \({{0,2} \over {0,4}} < {4 \over 5} \to \) lượng oxi dư, vậy phải tính khối lượng \({P_2}{O_5}\) theo photpho
\({n_{{P_2}{O_5}}} = {{0,2 \times 2} \over 4} = 0,1(mol)\)
Khối lượng \({P_2}{O_5}\) thực tế thu được : 0,1 x 142 x 80% = 11,36(g)
Bài 24.19 Trang 34 Sách bài tập (SBT) Hóa học 8
Đốt cháy một hỗn hợp gồm bột Fe và Mg, trong đó Mg có khối lượng 0,48 g cần dùng 672 ml O2 (ở đktc). Hãy tính khối lượng kim loại Fe.
Hướng dẫn giải
\({n_{Mg}} = {{0,48} \over {24}} = 0,02(mol);{n_{{O_2}}} = {{672} \over {22400}} = 0,03(mol)\)
Phương trình hóa học của phản ứng :
\(2Mg + {O_2} \to 2MgO\)
2mol 1mol
0,02mol 0,01mol
\({n_{{O_2}}}\) còn lại tác dụng với Fe : 0,03 - 0,01 = 0,02(mol)
\(3Fe\,\,\,\,\, + \,\,\,\,2{O_2} \to \,\,\,F{e_3}{O_4}\)
3mol 2mol
0,03mol \( \leftarrow \)0,02mol
\({m_{Fe}} = 0,03 \times 56 = 1,68(g)\)




