Bài 21: Khái quát về nhóm Halogen
Bài tập trắc nghiệm 5.1, 5.2 trang 46 Sách bài tập (SBT) Hóa học 10
5.1 . Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là \(ns^2np^5\) ?
A. Nhóm IVA. B. Nhóm VA.
C. Nhóm VIA. D. Nhóm VIIA.
5.2. Các nguyên tử halogen đều có
A. 3e ở lớp electron ngoài cùng.
B. 5e ở lớp electron ngoài cùng,
C. 7e ở lớp electron ngoài cùng.
D. 8e ở lớp electron ngoài cùng.
Hướng dẫn giải
|
5.1 |
5.2 |
|
D |
C |
Bài 5.3 trang 46 Sách bài tập (SBT) Hóa học 10
Lập PTHH của các phản ứng giữa hiđro với flo, clo, brom, iot và cho biết các halogen đóng vai trò gì trong các phản ứng đó ?
Hướng dẫn giải
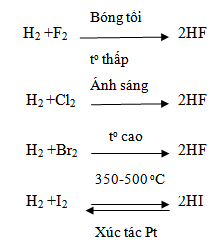
Trong các phản ứng trên, halogen đều đóng vai trò là chất oxi hoá.
Bài 5.4 trang 46 Sách bài tập (SBT) Hóa học 10
Hoàn thành PTHH của các phản ứng sau và nhận xét về số oxi hoá của các halogen trong hợp chất thu được.
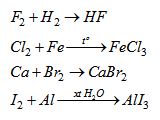
Hướng dẫn giải

Bài 5.5 trang 46 Sách bài tập (SBT) Hóa học 10
Xác định số oxi hoá của các nguyên tố halogen trong các chất sau và rút ra nhận xét về số oxi hoá của chúng trong các hợp chất.
a) \(F_2, HF, NaF, BaF_2\)
b) \(Cl_2, HC1, NaCl, NaClO, NaClO_2, NaC1O_3, NaC1O_4\).
c) \(Br_2, HBr, NaBr, HBrO, HBrO_2, HBrO_3, KBrO_4\).
d) \(I_2, HI, Nai, HIO, HIO_2, HIO_3, HIO_4\).
Hướng dẫn giải
Nhận xét:
- Flo chỉ có số oxi hoá -1 trong các hợp chất.
- Clo ngoài số oxi hoá -1 còn có các số oxi hoá +1, +3, +5, +7.
- Brom và iot có số oxi hoá tương tự như số oxi hoá của clo trong các hợp chất.
Bài 5.6 trang 47 Sách bài tập (SBT) Hóa học 10
Xác định các chất trong sơ đồ chuyển hoá sau :
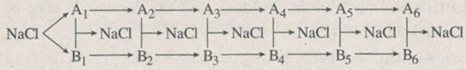
Hướng dẫn giải
\(A_1, B_1\) là \(Na , Cl_2\)
\(A_2, B_2\) là \(Na_2O , HCl\)
\(A_3, B_3\) là \(NaOH , CaCl_2\)
\(A_4, B_4\) là \(Na_2CO_3 , ZnCl_2\)
\(A_5, B_5\) là \(Na_3PO_4 , MgCl_2\)
\(A_6, B_6\) là \(Na_2SO_4 , BaCl_2\)
Bài 5.7 trang 47 Sách bài tập (SBT) Hóa học 10
Một nguyên tố halogen có cấu hình electron lớp ngoài cùng của nguyên tử là \(4s^2 4p^5\)
a) Viết cấu hình electron đầy đủ của nguyên tử nguyên tố đó.
b) Cho biết tên, kí hiệu hoá học và cấu tạo phân tử của đơn chất halogen này.
c) Nêu tính hoá học cơ bản của nguyên tố trên.
d) So sánh tính chất hoá học của nguyên tố này với 2 nguyên tố halogen khác đứng trên và dưới nó trong nhóm halogen.
Hướng dẫn giải
a) \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^10 4s^2 4p^5\)
b) Đó là brom, kí hiệu hoá học là Br, phân tử gồm 2 nguyên tử liên kết với nhau bằng 1 liên kết cộng hoá trị.
c) Tính chất hoá học cơ bản là tính oxi hoá mạnh.
d) Brom có tính oxi hoầ yếu hơn clo nhưng mạnh hơn iot.
\(Cl_2 + 2NaBr → 2NaCl + Br_2\)
\( Br_2 + 2NaI → 2NaBr + I_2\)
Bài 5.8 trang 47 Sách bài tập (SBT) Hóa học 10
Viết PTHH của các phản ứng xảy ra khi cho clo và iot lần lượt tác dụng với dung dịch KOH ở nhiệt độ thường. Giải thích vì sao có sự khác nhau ở 2 phản ứng đó:
Hướng dẫn giải
\(Cl_2 + 2KOH → KC1 + KClO + H_2O\)
\(3I_2 + 6KOH → 5KI + KI_O3 + 3H_2O\)
Trong môi trường kiềm, ion \(XO^-\) phân huỷ theo phản ứng sau :
\(3XO^-→ 2X^-+ XO3^-\) (kí hiệu X là halogen)
lon \(ClO^-\) phân huỷ rất chậm ở nhiệt độ thường, phân huỷ nhanh ở nhiệt độ trên 75°C
Ion \(IO^-\) phân huỷ ở tất cả các nhiệt độ trên, do đó ở nhiệt độ thường, ta có 2 phản ứng trên.
Bài 5.9 trang 47 Sách bài tập (SBT) Hóa học 10
Cho 5 gam brom có lẫn tạp chất là clo vào một dung dịch chứa 1,600 gam KBr. Sau phản ứng làm bay hơi dung dịch thì thu được 1,155 gam chất rắn khan. Xác định % về khối lượng của clo trong 5 gam brom đem phản ứng.
Hướng dẫn giải
Khối lượng muối giảm là :
1,600- 1,155 = 0,445 (g)
71 g 238 g 149 g khối lượng muối giảm đi 89 g
xg 0,445 g
Ta có:
Bài 5.10 trang 47 Sách bài tập (SBT) Hóa học 10
Khi cho 20 \(m^3\) không khí có chứa khí clo đi qua một ống đựng muối KBr, khối lượng của muối đó giảm bớt 178 mg. Xác-định làm lượng của khí clo \((mg/m^3)\) trong không khí.
Hướng dẫn giải
\(Cl_2 + 3KBr →2KCl + Br_2\)
1 mol 238 g 149 g 1 mol; khối lượng muối giảm 89 g
x mol 0,178g
\(x = {{0,178} \over {89}} = 0,002\left( {mol} \right)\)
Lượng khí clo có trong \(20 m^3\) không khí là :
71.0,002=0,0142 (g) hay 14,2 mg
Hàm lượng của khí clo trong không khí là:
\({{14,2} \over {20}} = 7,1\left( {mg/{m^3}} \right)\)
Bài 5.11 trang 47 Sách bài tập (SBT) Hóa học 10
Có 2 khí không màu, dễ tan trong nước, dung dịch thu được cho tác dụng với dung dịch \(AgNO_3\) tạo ra kết tủa màu vàng
a) Cho biết tên 2 khí đó.
b) Hãy phân biệt 2 khí đó bằng phương pháp hoá học.
Hướng dẫn giải
a) Hai khí đó là HBr và HI
\(HBr+AgNO_3→AgBr↓+HNO_3\)
\(HI+ AgNO_3→AgI↓+HNO_3\)
b) Dẫn từng khí đó đi qua nước clo có pha sẵn hồ tinh bột, chất nào tạo ra chất mới có màu xanh là HI.
\(Cl_2+HI→2HCl+I_2\)




