Bài 4. Một số axit quan trọng
Bài 1 (SGK trang 19)
Có những chất: CuO, BaCl2 Zn, ZnO. Chất nào nói trên tác dụng với dung dịch HCl, dung dịch H2SO4 loãng sinh ra:
a) chất khí cháy được trong không khí ?
b) Dung dịch có màu xanh lam?
c) chất kết tủa màu trắng không tan trong nước và axit ?
d) dung dịch không màu và nước ?
Viết tất cả các phương trình hóa học.
Hướng dẫn giải
a) Khí cháy được trong không khí là hiđro
Zn + 2HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2
b) Dung dịch có màu xanh lam là dung dịch muối đồng (II)
CuO + 2HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
c) Chất kết tủa trắng không tan trong nước và axit là BaSO4
BaCl2 + H2SO4 → 2HCl + BaSO4
d) Dung dịch không màu là muối kẽm.
ZnO + 2HCl → ZnCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
Bài 2 (SGK trang 19)
Sản xuất axit sunfuric trong công nghiệp cần phải có những nguyên liệu chủ yếu nào ? Hãy cho biết mục đích của mỗi công đoạn sản xuất axit sunfuric và dẫn ra những phản ứng hóa học.
Hướng dẫn giải
Bài giải:
Nguyên liệu là lưu huỳnh(hoặc quặng pirit), không khí và nước
- sản xuất SO2 bằng cách đốt S trong không khí
S + O2 ----> SO2
- sản suất SO3 bằng cách oxi hóa SO2( chất xúc tác là V2O5 ở nhiệt độ 450 độ C)
2SO2 + O2 -----> 2SO3
- sản xuất H2SO4 bằng cách cho SO3 t/d với H2O
SO3 + H2O ----> H2SO4
Bài 3 (SGK trang 19)
Bằng cách nào có thể nhận biết được từng chất trong mỗi cặp chất sau theo phương pháp hóa học ?
a) Dung dịch HCl và dung dịch H2SO4
b) Dung dịch NaCl và dung dịch Na2SO4
c) Dung dịch Na2SO4 và H2SO4
Viết phương trình hóa học
Hướng dẫn giải
a) Dung dịch HCl và dung dịch H2SO4
-Cho CaO vào hai dung dịch HCl và H2SO4
Cả 2 phản ứng đều tác dụng,duy chỉ có phản ứng vs H2SO4 thì tạo ra kết tủa màu trắng.
PT:CaO + 2 HCl --->CaCl2 + H2O
CaO + H2SO4 ----->CaSO4 (kết tủa trắng) + H2O
b) Dung dịch NaCl và dung dịch Na2SO4
-Dùng dung dịch H2SO4 để phân biệt,Na2SO4 không tác dụng,chỉ có NaCl tác dụng.
PY: NaCl + H2SO4 ---> Na2SO4 + HCl
c) Dung dịch Na2SO4 và H2SO4
-Dùng quỳ tím để phân biệt
H2So4 làm quỳ tím chuyển đỏ
Bài 4 (SGK trang 19)
Bảng dưới đây cho biết kết quả của 6 thí nghiệm xảy ra giữa Fe và dung dịch H2SO4 loãng. Trong mỗi thí nghiệm người ta dùng 0,2 gam Fe tác dụng với thể tích bằng nhau của axit, nhưng có nồng độ khác nhau.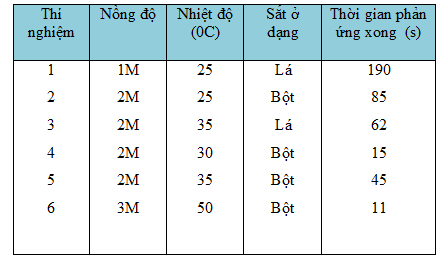
Những thí nghiệm nào chứng tỏ rằng:
a) Phản ứng xảy ra nhanh hơn khi tăng nhiệt độ ?
b) Phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc ?
c) Phản ứng xảy ra nhanh hơn khi tăng nồng độ axit ?
Hướng dẫn giải
So sánh các điều kiện: nồng độ axit, nhiệt độ của dung dịch H2SO4 loãng và trạng thái của sắt với thời gian phản ứng để rút ra:
a) Thí nghiệm 4 và thí nghiệm 5 chứng tỏ phản ứng xảy ra nhanh hơn khi tăng nhiệt độ của dung dịch H2SO4.
b) Thí nghiệm 3 và thí nghiệm 5 chứng tỏ phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc.
c) Thí nghiệm 4 và thí nghiệm 6 chứng tỏ phản ứng xảy ra nhanh hơn khi tăng nồng độ của dung dịch H2SO4.
Bài 5 (SGK trang 19)
Hãy sử dụng những chất có sẵn: Cu, Fe, KOH, C6H12O6 (glucozơ), dung dịch H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit
b) H2SO4 đặc có những tính chất hóa học riêng
Viết phương trình hóa học cho mỗi thí nghiệm.
Hướng dẫn giải
a) Để chứng minh dung dịch H2SO4 loãng có những tính chất hóa học của axit, ta thực hiện các thí nghiệm:
Cho axit H2SO4 loãng lần lượt phản ứng với Fe, CuO, KOH:
Fe + H2SO4 → FeSO4 + H2 (có khí thoát ra)
(kim loại Cu không tác dụng với dd H2SO4 loãng)
CuO + H2SO4 → H2O + CuSO4 (dung dịch có màu xanh lam)
2KOH + H2SO4 → K2SO4 + H2O
(Cho quỳ tím vào dung dịch KOH, dung dịch có màu xanh. Rót từ từ dung dịch H2SO4 thấy màu xanh dần biến mất đến khi dung dịch không màu)
b) Để chứng minh dung dịch H2SO4 đặc có những tính chất hóa học riêng ta thực hiện các thí nghiệm:
Cho axit H2SO4 đặc tác dụng với Cu đun nóng và với glucozơ:
Cu + H2SO4 đ, nóng → CuSO4 + SO2 + H2O
(Đồng bị hòa tan dần, dung dịch chuyển sang màu xanh và có khí mùi hắc thoát ra)
C12H22O11 \(\underrightarrow{H_2SO_4}\) 12C + 11H2O
(Đường bị hóa thành than và đẩy lên khỏi cốc)
Bài 6 (SGK trang 19)
Cho một khối lượng mạt sắt dư vào 50 ml dung dịch HCl. Phản ứng xong, thu được 3,36 lít khí (đktc).
a) Viết phương trình hóa học;
b) Tính khối lượng mạt sắt đã tham gia phản ứng
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Hướng dẫn giải
a) Số mol khí H2 = 3,36 : 22,4 = 0,15 mol
a) Phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2
Phản ứng 0,15 0,3 0,15 ← 0,15 (mol)
b) Khối lượng sắt đã phản ứng:
mFe = 0,15 . 56 = 8,4 g
c) Số mol HCl phản ứng:
nHCl = 0,3 mol; 50 ml = 0,05 lít
Nồng độ mol của dung dịch HCl: CM,HCl = \(\dfrac{0,3}{0,05}\) = 6M
Bài 7 (SGK trang 19)
Hòa tan hoàn toàn 12,2 gam hỗn hợp bột CuO và ZnO cần 100 ml dung dịch HCl 3M.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
c) Hãy tính khối lượng dung dịch H2SO4 nồng độ 20% để hòa tan hoàn toàn hỗn hợp các oxit trên.
Hướng dẫn giải
Số mol HCl = 3 . \(\dfrac{100}{1000}\) = 0,3 mol
Gọi x, y là số mol của CuO và ZnO
a) Các phương trinh hóa học:
CuO + 2HCl → CuCl2 + H2O
Phản ứng x 2x x (mol)
ZnO + 2HCl → ZnCl2 + H2O
Phản ứng: y 2y y (mol)
b) Từ khối lượng của hỗn hợp và số mol HCl, ta lập hệ phương trình.
\(\left\{{}\begin{matrix}80x+81y=12,1\\2x+2y=0,3\end{matrix}\right.\)
Giải (1)(2) ta được x = 0,05 mol = số mol CuO; y = 0,1 mol = số mol ZnO
%CuO = \(\dfrac{m_{CuO}}{m_{hh}}\) . 100% = \(\dfrac{0,05\times80\times100}{12,1}\) = 33%
c) Vì CuO và ZnO phản ứng với H2SO4 theo cùng tỉ lệ mol, nên có thể coi hai oxit như một oxit có công thức chung là MO với số mol = x + y = 0,15 mol
MO + H2SO4 → MSO4 + H2O
Phản ứng: 0,15 0,15 0,15 (mol)
m H2SO4 = 0,15 . 98 = 14,7 g
m dd H2SO4 20% = \(\dfrac{14,7\times100}{20}\) = 73,5 g




