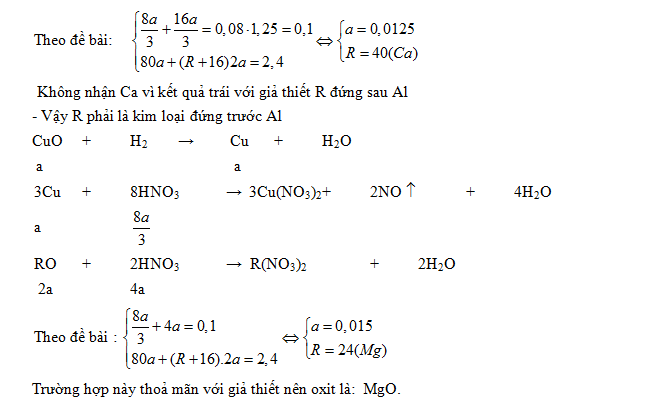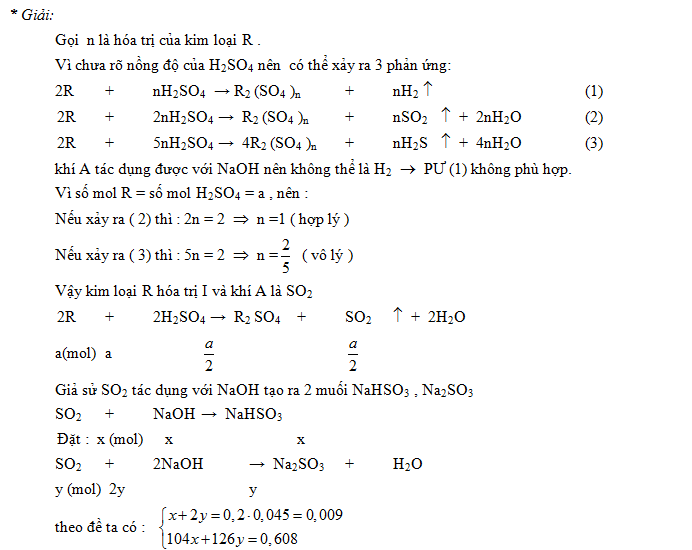Bài 22. Luyện tập chương II: Kim loại
* NHẬN BIẾT KIM LOẠI VÀ HỢP CHẤT CỦA KIM LOẠI
1) Nguyên tắc:
-Phải trích mỗi chất một ít để làm mẫu thử
-Phản ứng chọn để nhận biết các chất phải xảy ra nhanh và có dấu hiệu đặc trưng (đổi màu, xuất hiện kết tủa, sủi bọt khí, mùi đặc trưng…)
2) Phương pháp:
Phân loại các chất mất nhãn → xác định tính chất đặc trưng → chọn thuốc thử
Chú ý:
-Nếu chất A là thuốc thử của chất B thì chất B cũng là thuốc thử của A
-Nếu chỉ được lấy thêm 1 thuốc thử, thì chất lấy vào phải nhận ra được 1 chất sao cho chất này có khả năng làm thuốc thử cho các chất còn lại
-Nếu không dùng thuốc thủ thì dùng các phản ứng phân hủy hoặc cho tác dụng đôi một
-Khi chứng minh sự có mặt của 1 chất trong hỗn hợp thì rất dễ nhầm lẫn, vì vậy thuốc thử được dùng cần phải đặc trưng
* Tóm tắt thuốc thử và dấu hiệu nhận biết 1 số chất
Ví dụ1: Có 8 dung dịch chứa: NaNO3, Mg(NO3)2, Fe(NO3)2, Cu(NO3)2, Na2SO4, MgSO4, FeSO4, CuSO4. Hãy nêu các thuốc thử và trình bày phương án phân biệt 8 dung dịch nói trên.
Giải:
Thuốc thử để phân biệt là: dd BaCl2, dd NaOH. Cách làm như sau:
- Cho dd BaCl2 vào 8 dung dịch sẽ thấy ở 4 dung dịch có kết tủa là: Na2SO4, MgSO4, FeSO4, CuSO4 (nhóm A) còn 4 dung dịch không có hiện tượng gì là: NaNO3, Mg(NO3)2, Fe(NO3)2, Cu(NO3)2 (nhóm B).
- Trong mỗi nhóm A, B đều dùng dd NaOH để thử:
Nhận ra Na2SO4 và NaNO3 không có hiện tượng gì
Nhận ra CuSO4 và Cu(NO3)2 tạo kết tủa màu xanh:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Xanh
Nhận ra MgSO4 và Mg(NO3)2 tạo kết tủa màu trắng:
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ + 2NaNO3
Trắng
Nhận ra FeSO4 và Fe(NO3)2 tạo kết tủa màu trắng hơi xanh, sau đó một lúc kết tủa sẽ chuyển thành màu nâu đỏ
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓ nâu đỏ
Ví dụ 2: Nhận biết các kim loại sau: Al, Fe, Cu
Giải:
- Lấy mỗi kim loại 1 ít, lần lượt cho dung dịch axit loãng HCl vào từng kim loại
Kim loại nào không tan là Cu.
Kim loại nào tan có hiện tượng sủi bọt khí k màu không mùi là Al, Fe
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
- Cho dung dịch NaOH vào 2 kim loại còn lại :Al, Fe
Kim loại nào có hiện tượng sủi bọt khí không màu không mùi là Al, không có hiện tượng gì là Fe
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Ví dụ 3: Trình bày phương pháp hoá học để nhận biết các kim loại sau: Al, Ag, Fe, Mg
Giải: - Dùng NaOH vào 4 mẫu thử
Mẫu nào tan và có xuất hiện sủi bọt khí là Al.
2Al+2NaOH+2H2O=>2NaAlO2+3H2
+Mẫu nào không tan là Ag,Fe,Mg.
- Dùng dd HCl để phân biệt mẫu thử của 3 kim loại:
+Mẫu nào tan và xuất hiện sủi bọt khí là Fe,Mg(nhóm I)
Fe+2HCl=>FeCl2+H2
Mg+2HCl=>MgCl2+H2
+Mẫu thử không tan là Ag.
- Dùng dd NaOH vào dung dịch sản phẩm của nhóm I:
+Mẫu thử nào xuất hiện kết tủa trắng thì ban đầu là Mg.
MgCl2+2NaOH=>Mg(OH)2+2NaCl
+Mẫu thử nào xuất hiện kết tủa màu xanh nhạt thì ban đầu là Fe.
FeCl2+2NaOH=>Fe(OH)2+2NaCl
Ví dụ 4: Phân biệt 9 chất rắn sau bằng 2 hóa chất tự chọn: Ag2O, BaO, MgO, MnO2, Al2O3, FeO, Fe2O3, CaCO3, CuO?
Giải: Hai thuốc thử là H2O , HCl đặc nóng
- Nhận BaO tan trong H2O tạo Ba(OH)2
- Dùng Ba(OH)2 nhận Al2O3:
-> Al2O3 tan được trong Ba(OH)2 theo phản ứng:
Al2O3 + Ba(OH)2 -> Ba(AlO2)2 + H2O
- Dùng HCl đặc nóng nhận biết được
+ Ag2O : Ag2O + 2HCl -> 2AgCl (kết tủa trắng hóa đen trong không khí) + H2O
+ CuO : CuO + 2HCl -> CuCl2 (dung dịch màu xanh lam) + H2O
+ CaCO3 : CaCO3 + 2HCl -> CaCl2 + CO2 (khí không màu) + H2O
+ MnO2 : MnO2 + 4HCl (đặc, nóng) -> MnCl2 + Cl2 (khí vàng lục) + 2H2O (nếu không là HCl đặc nóng thì sẽ không phản ưng)
-> Còn MgO, FeO, Fe2O3 tan trong HCl tạo thành các dung dịch khó phân biệt màu và không có khí thoát ra là MgCl2, FeCl2, FeCl3.
* CÁC DẠNG TOÁN BIỆN LUẬN VỀ KIM LOẠI
A. PHƯƠNG PHÁP GIẢI
Nguyên tắc áp dụng:
- Phương pháp này được áp dụng trong các bài toán xác định tên nguyên tố mà các dữ kiện đề cho thiếu hoặc các số liệu về lượng chất đề cho đã vượt quá, hoặc chưa đạt đến một con số nào đó.
- Cần sử dụng những tính chất đặc trưng của kim loại để tìm ra chìa khóa để giải toán. Để giải được bài toán biện luận cần nắm được:
+ Nguyên tử khối của kim loại luôn là số nguyên dương
+ Hóa trị của kim loại thường là: 1, 2, 3
+ Tinh thể ngậm nước luôn chứa số phân tử nước là số nguyên dương
VD: CuSO4. 5H2O hoặc H2SO4. 3 H2O
+ Dãy hoạt động hóa học của kim loại, ý nghĩa của dãy hoạt động hóa học
* Cần lưu ý một số điểm hỗ trợ việc tìm giới hạn thường gặp:
+) Hỗn hợp 2 chất A, B có số mol là a( mol) thì : 0 < nA, nB < a
+) Trong các oxit : R2Om thì : 1 £ m, nguyên £ 7
+) Trong các hợp chất khí của phi kim với Hiđro RHn thì : 1 £ n, nguyên £ 4
DẠNG 1: BIỆN LUẬN THEO ẨN SỐ TRONG GIẢI PHƯƠNG TRÌNH
Ví dụ 1: Hòa tan một kim loại chưa biết hóa trị trong 500ml dd HCl thì thấy thoát ra 11,2 dm3 H2 (đktc). Phải trung hòa axit dư bằng 100ml dd Ca(OH)2 1M. Sau đó cô cạn dung dịch thu được thì thấy còn lại 55,6 gam muối khan. Tìm nồng độ M của dung dịch axit đã dùng; xác định tên của kim loại đã đã dùng.
Cặp ẩn cần biện luận là nguyên tử khối R và hóa trị x
55,6 gam là khối lượng của hỗn hợp 2 muối RClx và CaCl2
* Giải :
Giả sử kim loại là R có hóa trị là x => x >= 1, nguyên, x<3
số mol Ca(OH)2 = 0,1´ 1 = 0,1 mol
số mol H2 = 11,2 : 22,4 = 0,5 mol
Các PTPƯ:
2R + 2xHCl → 2RClx + xH2 (1)
1/x (mol) 1 1/x 0,5
Ca(OH)2 + 2HCl → CaCl2 + 2H2O (2)
0,1 0,2 0,1
từ các phương trình phản ứng (1) và (2) suy ra:
nHCl = 1 + 0,2 = 1,2 mol
nồng độ M của dung dịch HCl : CM = 1,2 : 0,5 = 2,4 M
theo các PTPƯ ta có :
Ví dụ 2: Khi cho a (mol ) một kim loại R tan vừa hết trong dung dịch chứa a (mol ) H2SO4 thì thu được 1,56 gam muối và một khí A. Hấp thụ hoàn toàn khí A vào trong 45ml dd NaOH 0,2M thì thấy tạo thành 0,608 gam muối. Hãy xác định kim loại đã dùng.
GV: Cho HS biết H2SO4 chưa rõ nồng độ và nhiệt độ nên khí A không rõ là khí nào.Kim loại không rõ hóa trị; muối tạo thành sau phản ứng với NaOH chưa rõ là muối gì. Vì vậy cần phải biện luận theo từng trường hợp đối với khí A và muối Natri.
HS: Nêu các trường hợp xảy ra cho khí A : SO2 ; H2S ( không thể là H2 vì khí A tác dụng được với NaOH ) và viết các PTPƯ dạng tổng quát, chọn phản ứng đúng để số mol axit bằng số mol kim loại.
GV: Lưu ý với HS khi biện luận xác định muối tạo thành là muối trung hòa hay muối axit mà không biết tỉ số mol cặp chất tham gia ta có thể giả sử phản ứng tạo ra 2 muối. Nếu muối nào không tạo thành thì có ẩn số bằng 0 hoặc một giá trị vôlý.