Phản ứng axit tác dụng với bazơ còn được gọi là phản ứng trung hoà. Axit HnA tác dụng với bazơ M(OH)m tạo muối và nước.
mHnA + nM(OH)m → MnAm + m.nH2O
Lưu ý:
-Nếu bài toán là hỗn hợp các axit và bazơ tác dụng với nhau, ta tính toán theo phương trình ion rút gọn:
H+ + OH- → H2O
-Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
Phương pháp giải:
- Bước 1: Viết PTHH xảy ra.
- Bước 2: Tính toán theo phương trình hoá học, đặt ẩn số nếu bài toán là hỗn hợp.
- Bước 3: Lập phương trình và giải hệ phương trình ⇒ Số mol các chất cần tìm.
- Bước 4: Tính toán theo yêu cầu của bài toán.
Bài tập vận dụng
Bài 1: Cần bao nhiêu ml dung dịch KOH 1,5M để trung hoà 300ml dung dịch H2SO4 0,75M.
Hướng dẫn:
PTHH:
2KOH + H2SO4 → K2SO4 + 2H2O
Theo đề bài, ta có:
nH2SO4 = 0,75.0.3 = 0,225 mol ⇒ nKOH = 2.nH2SO4 =2.0,225 = 0,45 mol
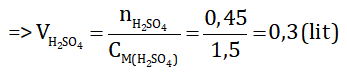
Vậy cần 300 ml dung dịch KOH 1,5M để trung hoà dung dịch axit sunfuric.
Bài 2: Để trung hoà 10ml dung dịch hỗn hợp axit gồm H2SO4 và HCl cần dùng 40ml dung dịch NaOH 0,5M. Mặt khác, lấy 100ml dung dịch axit đem trung hoà một lượng xút vừa đủ rồi cô cạn thì thu được 13,2g muối khan. Tính nồng độ mol/l của mỗi axit trong dung dịch ban đầu.
Hướng dẫn:
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + H2O
Hay: H+ + OH- → H2O
Gọi nồng độ của axit HCl và axit H2SO4 lần lượt là xM và yM.
Theo đề bài, ta tính được số mol NaOH dùng để trung hoà 10ml hỗn hợp axit là: nNaOH(1) = 0,5.0,04 = 0,02 mol
⇒ Phương trình 1:

Mặt khác, tổng khối lượng muối khan thu được khi trung hoà 100ml hỗn hợp axit là 13,2g.
⇒ Phương trình 2: mmuối = mNaCl + m ⇒ x.0,1.58,5 + y.0,1.142 = 13,2
Giải hệ phương trình:

Vậy nồng độ mol của axit HCl là 0,8M và của axit H2SO4 là 0,6M
Được cập nhật: 24 tháng 4 lúc 12:23:36 | Lượt xem: 475




