Đề ôn thi học kì 1 Hóa lớp 10 đề số 8Đề ôn thi học kì 1 Hóa lớp 10 đề số 7
Nội dung tài liệu
Tải xuốngCác tài liệu liên quan
-
![Đề ôn thi học kì 1 Hóa lớp 10 đề số 8Đề ôn thi học kì 1 Hóa lớp 10 đề số 7]()
-
![Giáo án PTNL Hóa lớp 10]()
-
![Tài liệu ôn tập HKII năm học 2020-2021 môn Hóa 10, trường THPT Xuân Đỉnh - Hà Nội]()
-
![Tài liệu môn Hóa 10, trường THPT Nguyễn Đức Cảnh - Thái Bình]()
-
![Đề kiểm tra 1 tiết hóa học 10 năm học 2018-2019, trường THPT Nguyễn Bỉnh Khiêm - Đắk Lắk]()
-
![Đề cương ôn thi HKI Hóa 10, trường THPT Xuân Đỉnh - Hà Nội năm học 2020-2021.]()
-
![Đề cương ôn tập kiểm tra giữa học kì II Hóa 10 chương trình chuyên, trường THPT Chuyên Bảo Lộc, năm học 2020-2021.]()
-
![Đề cương ôn tập kiểm tra giữa học kì II Hóa 10 chương trình cơ bản, trường THPT Chuyên Bảo Lộc, năm học 2020-2021.]()
-
![Chương Halogen Hóa 10, trường THPT Quốc Oai - Hà Nội.]()
-
![Tổng ôn Hóa học 10.]()
Có thể bạn quan tâm
Thông tin tài liệu
ĐỀ ÔN TẬP HỌC KÌ 1 (ĐỀ SỐ 7)
I. Phần trắc nghiệm:
Câu 1. Cho PTHH của phản ứng sau: aAl + bH2SO4 cAl2(SO4)3 + dH2S + eH2O
Tổng hệ số cân bằng (b + c) là:
A. 12 B. 19 C. 18 D. 15
Câu 2 Cho 9,6 g kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 2,24 lít khí duy nhất NO (đktc). M là:
A. Mg B. Fe C. Zn D. Cu
Câu 3 Hỗn hợp X gồm Cu và Fe. Trong đó Cu chiếm 43,24% khối lượng. Cho14,8 g X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc) bay ra. Giá trị của V là:
A. 3,36 lít B. 2,24 lít C. 4,48 lít D. 1,12 lít
Câu 4: Cho dãy các chất: FeO, Al2O3, Fe3O4, Fe(OH)2, HCl, Fe2O3. Số chất trong dãy bị oxi hoá bởi dung dịch H2SO4 đặc, nóng là
A. 6. B. 5. C. 4. D. 3.
Câu 5: Hoà tan 8,2 gam hỗn hợp X gồm Fe và Al bằng dd HCl tạo ra 7,84 lhí khí H2(đktc). Thành phần % khối lượng của Fe và Al trong X lần lượt là
A. 50% và 50% B. 65,85% và 34,15% C. 34,15% và 65,85% D. 20% và 80%
Câu 6. Cho 5,4 gam Al tác dụng với HNO3 thoát ra khí NO2 . Tính số mol HNO3 đóng vai trò môi trường:
A. 0,6 B. 0,2 C. 0,8 D. 0,5
Câu 7. Cho Al → Al3+ + 3e. Đi từ 13,5 gam Al . sẽ có bao nhiêu mol e được tách ra.
A. 0.5 B. 0.25 C. 1.5 D. 1.7
Câu 8. Trong phân tử CO2 có bao nhiêu liên kết pi.
A. 4 B. 2 C. 1 D. 3
Câu 9. Sắp xếp số e trong các ion sau theo thử tự tăng dần.
NH4+, SO32-, CO32-.
A. NH4+ < SO32- < CO32- B. NH4+ < CO32- < SO32-
C. SO32- < CO32-< NH4+ D. CO32-< NH4+ < SO32-
Câu 10. X , Y nằm cùng một chu kì, 2 nhóm liên tiếp có tổng e bằng 25. Tính số mol của e nhương đi từ 0,1 mol X và 0.2 mol Y.
A. 0.6 B.0,8 C. 0.7 D. 0.5
Câu 11. Cho 32 gam hỗn hợp Al, Fe, Zn tác dụng vừa đủ với V lít dung dịch HCl 0,5M thu được 44,2 gam muối. Giá trị V :
A. 0.2 lít B. 0.4 lít C. 0.8 lít D. số khác.
Câu 12. Nguyên tố X nằm chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây:
A. s B, p C. f D. d
Câu 13. X có hai đồng vị có số khối 13 và 11. Có % đồng vị bằng nhau. 0,25 mol X có khôi lượng:
A. 3 B. 12 C/ 4 D. 6
Câu 14: Cho phản ứng hoá học: Fe + CuSO4 FeSO4 + Cu. Trong phản ứng này đã xảy ra:
A. Sự oxi hoá Fe và sự oxi hoá Cu. B. Sự khử Fe2+ và sự oxi hoá Cu.
C. Sự khử Fe2+ và sự khử Cu2+ D. Sự oxi hoá Fe và sự khử Cu2+
Câu 15. Số liên kết pi và liên kết xichma trong phân tử H2CO3:
A. 5,1 B. 1.5 C. 2.4 D. 4.2
Câu 16. Cho 2,6 g bột kẽm vào 100 ml dung dịch CuCl2 0,75 M. Lắc đều cho đến khi phản ứng kết thúc. Khối lượng Cu kết tủa là bao nhiêu gam
A. 6.4 B. 2.56 C. 2.65 D. 4.6
Câu 17. Câu sai trong các câu sau đây:
A. Nước đá thuộc loại tinh thể phân tử.
B. Trong tinh thể phân tử, lực liên kết giữa các phân tử là liên kết cộng hóa trị.
C. Trong tinh thể phân tử, lực liên kết giữa các phân tử là liên kết yếu.
D. Tinh thể iot là tinh thể phân tử.
Câu 18: Hiđroxit cao nhất của một nguyên tố R có dạng HRO4. R cho hợp chất khí với hiđro chứa 2,74% hiđro theo khối lượng. R là nguyên tố
A. Br. B. Cl. C. I. D. F.
Câu 19: Cho 6,9g một kim loại X thuộc nhóm IA tác dụng với nước. Toàn bộ khí thu được cho tác dụng với CuO đun nóng. Sau phản ứng thu được 9,6g đồng kim loại. Kim loại X là
A. Na. B. Li. C. K. D. Rb.
Câu 20: Cho phản ứng hóa học: N2 +
O2 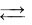 2NO có
2NO có
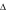 H
= +180kj
H
= +180kj
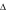 H của
phản ứng : NO → 1/2N2 + 1/2O2 có giá trị :
H của
phản ứng : NO → 1/2N2 + 1/2O2 có giá trị :
A. +90kj B. +-90kj C. +360kj D. -360kj
Câu 21. Cho một kim loại X có khối lượng 1.44 gam tác dụng vừa đủ với 500 ml dung dịch H2SO4 0.08M và HCl 0.08M. cô cạn dung dịch sau phản ứng thu được m gam muối. Tìm kim loại X và m ?
X là : m =
Câu 22. Hỗn hợp gồm 3 kim loại : Al, Fe, Cu có khối lượng m gam. Tác dụng với O2 ( dư) thu được 73 gam hỗn hợp các oxit gồm Al2O3, Fe3O4, FeO, Fe2O3, CuO. Để hòa tan hỗn hợp này cần dùng vửa đủ 146 gam dung dịch HCl 50%. Tính m ?
m = ............
Câu 23. Cho một kim loại X hóa trị n có khối lượng 1.215 gam. Tác dụng với dung dịch H2SO4 đặc, nóng (dư) thu được 378 ml khí H2S ( đktc). Tìm kim loại X.
Kim loại X là : ........
Câu 24. Cho một oxit Fe có khối lượng 139,2 gam tác dụng với dung dịch HNO3 ( dư) thì thu được muối Fe(NO3)3 và hỗn hợp hai khí NO2 và NO có thể tích 8.96 lít và có tỉ lệ mol NO2: NO = 3:1. Tìm công thức của oxit Fe.
Công thức của oxit Fe là : ...........
II. Phần tự luận:
Câu 1. A2+ có cấu hình electron của Ne, B2- có cấu hình electron của Ar.
Xác định vị trí của A và B trong bảng tuần hoàn.
Viết công thức oxit cao nhất của , hợp chất với H, công thức hidroxit cao nhất của A và B.
Cho hỗn hợp gồm A, B có khối lượng 2.64 gam (tỉ lệ mol A : B là 1:2). Cho hỗn hợp tác dụng với H2SO4 đặc dư, tính thể tích khí SO2 tạo thành.
Câu 2. Cho 10.1 gam hỗn hợp gồm hai kim loại kiềm (liên tiếp nhau) tác dụng với 90.2 gam nước thoát ra 3.36 lít khí H2 (đktc).
Xác định tên hai kim loại.
Tính C% của dung dịch tạo thành.
Cần dùng bao nhiêu lít dung dịch H2SO4 1M đê trùn hóa hết dung dịch tạo thành.











