I. Axit, bazơ, muối
1. Axit và bazơ theo thuyết Areniut:
Axit: H2O → H+; Bazơ H2O → OH-
*Axit nhiều nấc:
VD: H3PO4 ⇌ H+ + H2PO4-
H2PO4- ⇌ H++ HPO42-
HPO42- ⇌ H+ + PO43-
* Bazơ nhiều nấc:
VD: Mg(OH)2 ⇌ Mg(OH)+ + OH- ; Mg(OH)+ ⇌ Mg2+ + OH-
*Hiđroxit lưỡng tính:
A(OH)n : Zn(OH)2, Pb(OH)2, Sn(OH)2, Cu(OH)2, Al(OH)3, Cr(OH)3.
Phân li theo kiểu bazơ:
VD: Zn(OH)2 ⇌ Zn2+ + 2OH- ; Al(OH)3 ⇌ Al3+ + 3OH-
Phân li theo kiểu axit:
VD: Zn(OH)2 ⇌ ZnO22- + 2H+ ; Al(OH)3 ⇌ AlO2- + H3O+
2. Axit, bazơ theo Bronsted:
Axit là chất (hoặc ion) nhường proton H+.
Bazơ là chất (hoặc ion) nhận proton H+.
Chú ý:
Anion gốc axit còn H của axit yếu (H2CO3, H2SO3, H2S, H3PO4, ...) đều là chất lưỡng tính, còn anion không còn H của axit yếu đều là bazơ.
Hằng số phân li axit (Ka) và bazơ (Kb):
VD: CH3COOH ⇌ CH3COO- + H+
CH3COOH + H2O ⇌ CH3COO- + H+
VD: NH3 + H2O ⇌ NH4+ + OH-
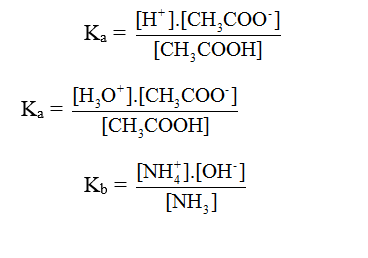
Sự điện li của muối trong nước:
VD: Na2SO4 → 2Na+ + SO42-
Muối axit, muối trung hoà:
+ Muối axit: Là muối mà gốc axit còn H có khả năng cho proton.
+ Muối trung hoà: Là muối mà gốc axit không còn H có khả năng cho proton.
II. pH của dung dịch

Được cập nhật: hôm kia lúc 16:58:03 | Lượt xem: 758




