Bài 19: Luyện tập về phản ứng oxi hóa khử
Bài 1 (SGK trang 88)
Loại phản ứng nào sau đây luôn luôn không là loại phản ứng oxi hoá - khử ?
A. Phản ứng hoá hợp. B. Phản ứng phân hủy.
C. Phản ứng thế trong hoá vô cd. D. Phản ứng trao đổi.
Hướng dẫn giải
Loại phản ứng nào sau đây luôn luôn không là loại phản ứng oxi hoá - khử ?
A. Phản ứng hoá hợp. B. Phản ứng phân hủy.
C. Phản ứng thế trong hoá vô cd. D. Phản ứng trao đổi.
Bài 2 (SGK trang 88)
Loại phản ứng nào sau đây luôn luôn là phản ứng oxi hoá - khử ?
A. Phản ứng hoá hợp B. Phản ứng phân hủy
c. Phản ứng thế trong hoá vô cơ D. Phản ứng trao đổi.
Hướng dẫn giải
Loại phản ứng nào sau đây luôn luôn là phản ứng oxi hoá - khử ?
A. Phản ứng hoá hợp B. Phản ứng phân hủy
c. Phản ứng thế trong hoá vô cơ D. Phản ứng trao đổi.
Bài 3 (SGK trang 88)
Cho phản ứng : M2Ox + HNO3 → M(NO3)3 + ...
Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại
phản ứng oxi hoá - khử ?
A. x = 1 B.x = 2 C.x = 1 hoặc x = 2 D. x = 3
Hướng dẫn giải
Câu D đúng
Bài 4 (SGK trang 88)
Câu nào đúng, câu nào sai trong các câu sau đây :
A. Sự oxi hoá một nguyên tố là lấy bớt electron của nguyên tố đó, là làm cho số oxi hoá của nguyên tố đó tăng lên.
B. Chất oxi hoá là chất thu electron, là chất chứa nguyên tố mà số oxi hoá của nó tăng sau phản ứng.
C. Sự khử một nguyên tô là sự thu thêm electron cho nguyên tố đó, làm cho số oxi hoá của nguyên tố đó giảm xuống.
D. Chất khử là chất thu electron, là chất chứa nguyên tố mà số oxi hoá của nó giảm sau phản ứng.
Hướng dẫn giải
Câu sai : B, D
Câu đúng : A, C
Bài 5 (SGK trang 88)
Hãy xác định số oxi hoá của các nguyên tố :
a) Nitơ trong NO, NO2, N2O5, HNO3, HNO2, NH3, NH4Cl.
b) Clo trong HCl, HClO, HClO2, HClO3, HClO4, CaOCl2
c) Mangan trong MnO2, KMnO4, K2MnO4; MnSO4.
d) Crom trong K2Cr2O7, Cr2(SO4)3, Cr2O3.
e) Lưu huỳnh trong H2S, SO2, H2SO3, H2SO4, FeS, FeS2.
Hướng dẫn giải
Đặt X là số oxi hoá của nguyên tố ni tơ trong các hợp chất trên ta có
Trong NO: x + (-2) = 0 -> X = +2
Trong NO2: x + 2(-2) = 0 -> x = +4
Trong N2O5 : 2x + 5(-2) = 0 \(\rightarrow\) x = +5
Trong HNO3 : (+1) + x + 3(-2) = 0 \(\rightarrow\) X = +5
Trong HNƠ2 : (+1) + x + 2(-2) = 0 \(\rightarrow\) X = +3
Trong NH3 : X + 3(+l) = 0 \(\rightarrow\) X = -3
Trong NH4Cl: X + 4(+l) + (-1) = 0 \(\rightarrow\) X = -3.
Cũng giải tương tự như trên ta có:
.jpg)
Bài 6 (SGK trang 88)
Cho biết đã xảy ra sự oxi hoá và sự khử những chất nào trong những phản ứng thế sau :
a) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
b) Fe + CuSO4 → FeSO4 + Cu
c) 2Na + 2H2O → 2NaOH + H2.
Hướng dẫn giải
.jpg)
Bài 7 (SGK trang 88)
Dựa vào sự thay đổi số oxi hoá, tìm chất oxi hoá và chất khử trong những phản ứng sau :
a) 2H2 + O2 → 2H2O
b) 2KNO3 → 2KNO2 + O2
c) NH4NO2 → N2 + 2H2O
d) Fe2O3 + 2Al → 2Fe + Al2O3.
Hướng dẫn giải
.jpg)
Bài 8 (SGK trang 88)
Dựa vào sự thay đổi số oxi hoá, hãy cho biết vai trò các chất tham gia trong các phản ứng oxi hoá - khử sau
a) Cl2 + 2HBr → 2HCI + Br2
b) Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
c) 2HNO3 + 3H2S → 3S + 2NO + 4H2O
d) 2FeCl2 + Cl2 → 2FeCl3.
Hướng dẫn giải
Vai trò các chất trong các phán ứng oxi hoá - khử sau là :a) : Chất khử : HBr, chất oxi hoá Cl2.b) Chất khử : Cu, chất oxi hoá : H2SO4c) Chất khử : H2S, chất oxi hoá : HNO3.d) Chất khử : FeCl2, chất oxi hoá : Cl2
Bài 9 (SGK trang 90)
Cân bằng các phương trình phản ứng oxi hoá - khử sau đây bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hoá ở mỗi phản ứng :
a) Al + Fe3O4 ⟶ Al2O3 + Fe
b) FeSO4 + KМNО4 + H2SO4 ⟶ Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
c) FeS2 + O2 ⟶ Fe2O3 + SO2
d) KClO3 ⟶ KCl + O2
e) Cl2+ KOH ⟶ KCl + KClO3 + H2O.
Hướng dẫn giải
a)

b)


c)

d)

e)


Bài 10 (SGK trang 90)
Có thể điều chế MgCl2 bằng :
- Phản ứng hoá hợp
- Phản ứng thế
- Phản ứng trao đổi.
Viết phương trình hoá học của các phản ứng.
Hướng dẫn giải
Điều chế MgCl2 bằng :
- Phản ứng hoá hợp : Mg + Cl2 —-> MgCl2
- Phản ứng thế : Mg + CuCl2 —-> MgCl2 + Cu
- Phản ứng trao đổi : Mg(OH)2 + 2HCl —-> MgCl2 + 2H2O
Bài 11 (SGK trang 90)
Cho những chất sau : CuO, dung dịch HCl, H2, MnO2.
a) Chọn từng cặp trong những chất đã cho để xảy ra phản ứng oxi hoá - khử và viết phương trình phản ứng.
b) Cho biết chất oxi hoá, chất khử, sự oxi-hoá và sự khử trong những phản ứng hoá học nói trên.
Hướng dẫn giải
Những cặp chất xảy ra phản ứng oxi hoá - khử :
(1)
(2) MnO2 + 4HCl > MnCl2 + Cl2 + 2H2O
b) Trong phản ứng (1) :
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hoá nguyên tử hiđro.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2) :
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hoá ion clo.
- Ion Mn nhận electron là chất oxi hoá. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.
Bài 12 (SGK trang 90)
Hòa tan 1,39g muối FeSO4.7H2O trong dung dịch H2SO4 loãng. Cho dung dịch này tác dụng với dung dịch KMnO4 0,1 M. Tính thể tích dung dịch KMnO4, tham gia phản ứng.
Hướng dẫn giải
\( n_{FeSO_{4}.7H_{2}O}\) = \( \frac{1,337}{278}\) = 0,005 mol = \( n_{FeSO_{4}}\)
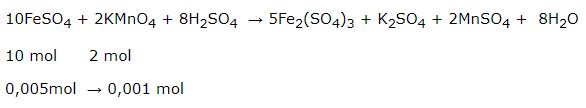
\( V_{dd KMnO_{4}}\) = \( \frac{0,001}{0,1}\) = 0,01 lít.




