Bài 4. Cấu tạo vỏ nguyên tử
Bài 1.39,1.40,1.41,1.42 trang 9 Sách bài tập (SBT) Hóa học 10
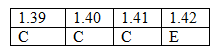
1.39 Hãy cho biết điều khẳng định nào dưới đây là đúng ?
A.Trong một nguyên tử thì số nơtron luôn luôn bằng số electron.
B.Trong một nguyên tử thì số nơtron luôn luôn bằng số proton.
C. Trong một nguyên tử thì số proton luôn luôn bằng số electron.
D. Trong một nguyên tử thì không có loại hạt nào bằng nhau.
1.40 Số electron có trong nguyên tử clo (Z = 17) là
A. 35 B. 18. C. 17. D. 16.
1.41 Lớp M có số phân lớp là
A. 1 phân lớp. B. 2 phân lớp. C. 3 phân lớp. D. 4 phân lớp.
1.42 Số electron tối đa có thể phân bố trên lớp O (n = 5-) là
A. 30. B. 40. C. 45. D. 50.
Hướng dẫn giải
Bài 1.43 trang 9 Sách bài tập (SBT) Hóa học 10
Hãy cho biết quan hệ giữa số đơn vị điện tích hạt nhân z với số proton, với số electron, với số thứ tự (của nguyên tố tương ứng trong bảng tuần hoàn).
Hướng dẫn giải
Số đơn vị điện tích hạt nhân Z = số proton = số electron = số thứ tự
Bài 1.44 trang 9 Sách bài tập (SBT) Hóa học 10
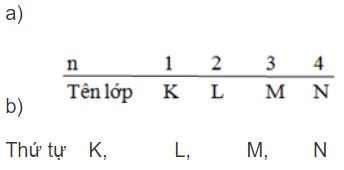
Các lớp electron được đặc trưng bằng các số nguyên (gọi là số lượng tử chính) n = 1, 2, 3, 4,… và được đặt tên bằng các chữ cái.
Hãy ghi tên lớp electron ứng với các lớp n = 1, n = 2, n = 3, n = 4.
Hãy sắp xếp các lớp đó theo thứ tự từ trong ra ngoài.
Hướng dẫn giải
Bài 1.46 trang 10 Sách bài tập (SBT) Hóa học 10
a) Hãy cho biết tên các phân lớp thuộc lớp N.
b) Sắp xếp các phân lớp đó theo thứ tự tăng dần của các mức năng lượng tương ứng.
Hướng dẫn giải
a) Lớp N ứng với n = 4 có 4 phân lớp: 4s,4p , 4d,4f.
b) Các mức năng lượng tăng dần theo thứ tự trên.
Bài 1.47 trang 10 Sách bài tập (SBT) Hóa học 10
Hãy cho biết số electron tối đa có thể phân bố trên :
Phân lớp s.
Phân lớp p.
Phân lớp d.
Phân lớp f.
Hãy cho nhận xét về quy luật của các số electron tối đa đó.
Hướng dẫn giải
Số electron tối đa có thể phân bố trên :
Phân lớp s : 2.
Phân lớp p : 6.
Phân lớp d : 10.
Phân lớp f : 14.
Nhận xét: Số electron tối đa trên các phân lớp s, p, d, f gấp 2 lần các số lẻ liên tiếp 1, 3, 5, 7.
Bài 1.48 trang 10 Sách bài tập (SBT) Hóa học 10
a) Hãy cho biết quan hệ giữa số nguyên n đặc trưng cho các lớp và số electron tối đa trên lớp tương ứng.
b) Hãy cho biết số electron tối đa trên các lớp K, L, M.
c) Tượng trưng mỗi lớp electron bằng một đường tròn và mỗi electron bằng một chấm, hãy vẽ sơ đồ mô tả số electron tối đa trên các lớp K, L, M.
Hướng dẫn giải
a) Một cách vắn tắt người ta nói lớp n có tối đa 2n2 electron.
b) Số electron tối đa trên lớp K (n=1) là 2.12
Số electron tối đa trên lớp L (n=2) là 2.22=8
Số electron tối đa trên lớp M (n=3) là 2.32=18
c) Sơ đồ như hình vẽ :
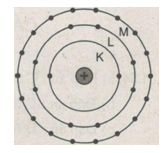
(Lớp K có tối đa 2 electron, lớp L có tối đa 8 electron, lớp M có tối đa 18 electron).
Bài 1.49 trang 10 Sách bài tập (SBT) Hóa học 10
Hãy viết các kí hiệu của các phân lớp thuộc lớp M theo thứ tự tăng dần của các mức năng lượng tương ứng.
Hướng dẫn giải
Lớp M (n = 3) có 3 phân lớp, năng lượng tăng dần từ 3s đến 3d : 3s, 3p, 3d.
Bài 1.50 trang 10 Sách bài tập (SBT) Hóa học 10
Nguyên tử của nguyên tố X có tổng số 3 electron trong lớp M. Xác định nguyên tố X.
Hướng dẫn giải
Cách 1 : Lớp M (lớp thứ 3) có 3e → cấu hình e lớp M là : \(3s^23p^1\) —> cấu hình e đầy đủ của X : \(ls^22s^22p^63s^23p^1\) \(Z_X\) = 13 -> X : Al
Cách 2 : Lớp M (lớp thứ 3) có 3e → cấu hình e lớp M là : \(3s^23p^1\) , lớp M chưa bão hòa e → M là lớp ngoài cùng → X có 3 lớp e → X thuộc chu kì 3 (STT chu kì = số lớp e), nhóm IIIA (STT nhóm = số e hoá trị, e cuối cùng được xếp vào phân lớp p nên X thuộc nhóm chính (nhóm A)) → X : Al.
Bài 1.51 trang 10 Sách bài tập (SBT) Hóa học 10
Vỏ electron của nguyên tử một nguyên tố A có 20e. Hãy cho biết :
+ Nguyên tử có bao nhiêu lớp e ?
+ Lớp ngoài cùng có bao nhiêu e ?
+ A là kim loại hay phi kim ? Xác định tên nguyên tố A.
Hướng dẫn giải
Cấu hình e của nguyên tử A : \(ls^22s^22p^63s^23p^64s^2\).
→ Nguyên tử A có 4 lớp e. Có 2 e ở lớp ngoài cùng (lớp thứ 4) → là kim loại (những nguyên tử có từ 1 đến 3 e ở lớp ngoài cùng), \(Z_A\) = 20 → A là Ca.
Bài 1.52 trang 10 Sách bài tập (SBT) Hóa học 10
Nguyên tố A có cấu hình e lớp ngoài cùng là \(4s^1\), nguyên tố B có phân lớp e cuối là \(3p^2\). Viết cấu hình đầy đủ và xác định tên nguyên tố A, K.
Hướng dẫn giải
Nguyên tố A là một trong ba trường hợp sau :
Nguyên tố B là silic : \(1{{\rm{s}}^2}2{{\rm{s}}^2}2{p^6}3{s^2}3{p^2}\) (Z=14)
Bài 1.53 trang 10 Sách bài tập (SBT) Hóa học 10
Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Một nguyên tử của nguyên tố Y có số hạt mang điện nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Xác định X, Y.
Hướng dẫn giải
X : Các phân lớp p của X có 7 e → có 2 phân lớp p →\(2p^6\) và \(3p^1\)
→ Cấu hình e của X :\( ls^22s^22p^63s^23p^1\) → z = 13 (Al)
Số hạt mang điện của X là \(2Z_X\) = 26 → Số hạt mang điện của Y : 26 + 8 = 34 → \(Z_Y\) = 17 (Cl).




