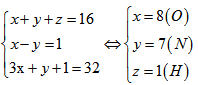Bài 12: Liên kết ion - Tinh thể ion
Bài tập trắc nghiệm 3.1, 3.2, 3.3, 3.4, 3.5, 3.6 trang 27 Sách bài tập ( SBT) Hóa học 10
3.1.Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
A. số khối. B. số electron.
C. số proton. D. số nơtron
3.2.Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. cho - nhận. B. kim loại.
C. ion D. cộng hoá trị.
3.3. X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
A. X2Y ; liên kết ion B. XY ; liên kết ion.
C. XY2 ; liên kết cộng hoá trị. D. X2Y2 ; liên kết cộng hoá trị.
3.4. Hợp chất trong phân tử có liên kết ion là
A. NH4Cl. B.NH3.
C. HCl. D.H2O.
3.5. Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1
và 1s22s22p5 thì liên kết này là
A. liên kết cộng hoá trị có cực .
B. liên kết cộng hoá trị không cực
C. liên kết ion
D. liên kết kim loại
3.6. Cấu hình electron nguyên tử A là [Ar]4s2 và nguyên tử B là [Ne]3s23p5.
Công thức hợp chất giữa A và B và bản chất liên kết trong hợp này là
A. AB2, ion. B. AB, ion.
C. A2B , cộng hoá trị. D.A2B3, kim loại.
Hướng dẫn giải
|
3.1 |
3.2 |
3.3 |
3.4 |
3.5 |
3.6 |
|
B |
C |
B |
A |
C |
A |
Bài 3.7 trang 27 Sách bài tập (SBT) Hóa học 10
Điện tích của electron và điện tích của proton (tính ra culông, C) bằng bao nhiêu ?
Hãy cho biết tên gọi và kí hiệu của các điện tích đó ?
Hướng dẫn giải
Điện tích của electron :qe= -1,602.10-19 c.
Điện tích của proton :qp= =1.602.10-19 c.
Các điện tích nhỏ bé đó được gọi là các điện tích đơn vị
Electron mang một điện tích đơn vị âm, kí hiệu bằng 1-.
Proton mang một điện tích đơn vị dương, kí hiệu bằng 1+.
Hai, ba, ... điộn tích đơn vị dương được kí hiệu bằng 2+, 3+,...
Hai, ba, … điện tích đơn vị âm được kí hiệu bằng 2-. 3-,.. .
Bài 3.8 trang 27 Sách bài tập (SBT) Hóa học 10
a) Hãy cho biết quan hệ giữa số proton và số electron trong nguyên tử. Tại sao nguyên tử lại trung hoà điện ?
b) Khi nguyên tử nhận thêm hay nhường đi một số electron thì phần tử còn lại có mang điện tích không và được gọi là gì ?
Hướng dẫn giải
a) Trong một nguyên tử, số proton luôn luôn bằng số electron, nghĩa là số điện tích dương và số điện tích âm bằng nhau nên nguyên tử trung hoà điện.
b) Khi nguyên tử nhận thêm hay bỏ ra một số electron thì số proton không còn bằng số electron nữa, nghĩa là số điện tích dương không còn bằng số điện tích âm nên phần tử được hình thành mang điện tích, được gọi là ion.
Nguyên tử hay nhóm nguyên tử mang điện tích được gọi là ion.
Bài 3.9 trang 27 Sách bài tập (SBT) Hóa học 10
Nguyên tử liti (Z = 3) có bao nhiêu proton, bao nhiêu electron ?
Khi nhường đi một electron thì ion được hình thành mang điện tích dương hay âm ?
lon đó thuộc loại ion gì ? Cho biết tên của ion đó.
Hãy viết phương trình hoá học diễn tả quá trình hình thành ion nói trên.
Hướng dẫn giải
Nguyên tử Li có 3 proton mang điện tích dương và 3 electron mang điện tích âm. Khi mất một electron thì ion có dư một điện tích dương nên ion được hình thành mang một điện tích dương (1+).
Ion mang điện tích dương nên thuộc loại ion dương hay cation
Ion của nguyên tố liti thì được gọi là ion liti (tên nguyên tố).
Phương trình : \(Li \to L{i^ + } + e\)
Bài 3.10 trang 27 Sách bài tập (SBT) Hóa học 10
Nguyên tử fio (Z = 9) có bao nhiêu proton, bao nhiêu electron ?
Khi nhận thêm một electron thì ion được hình thành mang điện tích dương hay âm ?
lon đó thuộc loại ion gì ? Cho biết tên của ion đó.
Hãy viết phương trình hoá học diễn tả quá trình hình thành ion nói trên.
Hướng dẫn giải
Nguyên tử F có 9 proton mang điện tích dương và 9 electron mang điện tích âm. Khi nhận thêm một electron thì ion có dư một điện tích âm nên ion được hình thành mang một điện tích âm (1-).
Ion mang điện tích âm nên thuộc loại ion âm hay anion.
Ion của flo được gọi là ion florua.
Phương trình : \(F + e \to {F^ - }\)
Bài 3.11 trang 27 Sách bài tập (SBT) Hóa học 10
Hãy viết các phương trình hoá học diễn tả sự hình thành các ion sau :
\(Na^+, Mg^{2+}, Al^{3+}, Cl^-, O^{2-}, S^{2-}\)
Hướng dẫn giải
Bài 3.12 trang 27 Sách bài tập (SBT) Hóa học 10
Trong hai loại nguyên tố là kim loại và phi kim thì loại nguyên tố nào dễ nhận electron, loại nguyên tố nào dễ nhường electron ? Cho thí dụ.
Hướng dẫn giải
Các kim loại dể nhường electron để trở thành ion dương.
Thí dụ :
Các phi kim dễ nhận electron để trở thành ion âm.
Thí dụ :
Bài 3.13 trang 27 Sách bài tập (SBT) Hóa học 10
Viết cấu hình electron nguyên tử của các nguyên tố sau đây : Al, Mg, Na, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử Al, Mg, Na, mỗi nguyên tử nhường mấy electron thì có cấu hình electron giống như của khí hiếm Ne.
Hãy cho biết tại sao các nguyên tử kim loại lại có khuynh hướng nhường electron để trở thành các ion dương ?
Hướng dẫn giải
Cấu hình electron của Al, Mg, Na, Ne :
|
Al 1s22s22p6(3s23p1) |
Mg 1s22s22p6(3s2) |
|
Na 1s22s22p6(3s1) |
Ne 1s22s22p6 |
Từ các cấu hình trên ta dễ dàng thấy rằng nếu :
nguyên tử Na nhường le để trở thành ion Na+ ;
nguyên tử Mg nhường 2e để trở thành ion Mg2+ ;
nguyên tử AI nhường 3e để trở thành ion Mg2+,
thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Ta đã biết cấu hình electron của các khí hiếm với 8 electron (đối với He là electron) ở lớp ngoài cùng là một cấu hình electron vững bền. Vì vậy, các nguyên tử kim loại có khuynh hướng dễ nhường electron để có cấu hình electron vững bền của khí hiếm đứng trước.
Bài 3.14 trang 27 Sách bài tập (SBT) Hóa học 10
Hãy viết cấu hình electron nguyên tử của các nguyên tố sau đây : O, F, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử O, F, mỗi nguyên tử nhận thêm mấy electron thì có cấu hình electron giống như của khí hiếm Ne đứng sau.
Hãy cho biết tại sao các nguyên tử phi kim lại có khuynh hướng nhận thêm electron để trở thành các ion âm ?
Hướng dẫn giải
|
O \(1s^22s^22p^4\) |
F \(1s^22s^22p^5\) |
Ne \(1s^22s^22p^6\) |
Từ các cấu hình trên ta dễ dàng thấy rằng nếu nguyên tử F nhận thêm le
để trở thành ion \(F^-\) ; nguyên tử O nhận thêm 2e để trở thành ion \( O^{2-}\); thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Như ta đã biết, cấu hình electron của các khí hiếm với 8 electron (đối với He là 2 electron) ở lớp ngoài cùng là một cấu hình electron vững bền (năng lượng thấp). Vì vậy, các nguyên tử phi kim có khuynh hướng nhận electron để có cấu hình electron vững bền của khí hiếm đứng sau.
Bài 3.15 trang 28 Sách bài tập (SBT) Hóa học 10
Hãy viết cấu hình electron nguyên tử của heli (He) và cấu hình electron của các cation : \(Be^{2+}, Li^+\).
So sánh cấu hình electron của các cation đó với cấu hình electron nguyên tử của He và cho nhận xét.
Hướng dẫn giải
|
He |
Be |
Li |
|
1s2 |
1s2 |
1s2 |
Nhận xét : Các cation \(Be^{2+}, Li^+\) có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm He đứng trước.
Bài 3.16 trang 29 Sách bài tập (SBT) Hóa học 10
Hãy viết cấu hình electron nguyên tử của agon (Ar) và cấu hình electron của các cation : \(Ca^{2+}, K^+\).
So sánh cấu hình electron của các cation đó với cấu hình electron nguyên tử của Ar và cho nhận xét.
Hướng dẫn giải
Nhận xét : Các cation có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm Ar đứng trước.
Bài 3.17 trang 29 Sách bài tập (SBT) Hóa học 10
Hãy viết cấu hình electron nguyên tử của agon (Ar) và cấu hình electron của các anion : .
Hãy so sánh cấu hình electron của các anion đó với cấu hình electron nguyên tử của Ar và cho nhận xét.
Hướng dẫn giải
Nhận xét : Các anion có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm Ar đứng sau.
Bài 3.18 trang 29 Sách bài tập (SBT) Hóa học 10
a) Hãy cho biết có hiện tượng gì xảy ra khi cho clo (thường ở dạng ) tác dụng với natri và hãy giải thích sự hình thành liên kết ion trong phân tử NaCl
b) Hãy cho biết thế nào là liên kết ion và bản chất lực liên kết ion là gì ?
Hướng dẫn giải
a) Ta đã biết natri là một kim loại có khuynh hướng nhường electron để trở thành một ion dương có cấu hình electron vững bền và clo là một phi kim có khuynh hướng nhận electron để trở thành một ion âm có cấu hình electron vững bền. Vì vậy khi cho clo tiếp xúc với natri thì trước hết có hiện tượng chuyển electron từ nguyên tử Na sang nguyên tử Cl. Từ đó xuất hiện các ion tích điện khác dấu (âm và dương) và sau đó do lực hút tĩnh điện giữa các ion nên liên kết ion được hình thành.
Phản ứng hoá học giữa natri và clo có thể được diễn tả bằng phương trình hoá học :
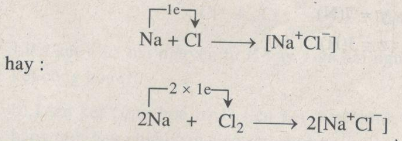
b) Liên kết ion là liên kết giữa các ion, xuất hiện do sự chuyển electron từ nguyên tử kim loại sang nguyên tử phi kim.
Bản chất lực liên kết ion là lực hút tĩnh điện giữa các ion tích điện khác dấu.
Bài 3.19 trang 29 Sách bài tập (SBT) Hóa học 10
a) Tại sao các hợp chất ion lại thường tồn tại ở trạng thái tinh thể ?
b) Hãy vẽ sơ đồ mạng tinh thể NaCl và hãy mô tả sự phân bố các ion trong mạng tinh thể đó.
Hướng dẫn giải
a) Lực hút tĩnh điện giữa các ion không định hướng : một ion dương có tác dụng hút đối với nhiều ion âm và ngược lại. Vì vậy, các hợp chất ion thường tồn tại ở dạng tinh thể. Các phân tử ion riêng rẽ chỉ tồn tại ở nhiệt độ cao (1440 °C đối với NaCl).
b) Hình bên là sơ đồ mạng tinh thể NaCl.
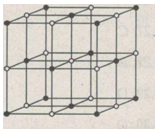
Trong tinh thể NaCl, các ion Na+; Cl- luân phiên phân bố trên các đỉnh của các hình lập phương nhỏ.
Mỗi ion được bao quanh bởi 6 ion khác dấu gần nhất.
Bài 3.20 trang 29 Sách bài tập (SBT) Hóa học 10
Hãy cho biết tính chất chung của các hợp chất ion.
Hướng dẫn giải
Vì lực hút tĩnh điện giữa các ion khác dấu lớn nên các tinh thể ion rất bền. Các hợp chất ion khó bay hơi, khó nóng chảy và khá rắn. Thí dụ, muối ăn (NaCl) có nhiệt độ nóng chảy là 800 °c.
Các hợp chất ion dễ tan trong nước. Ở trạng thái rắn, các hợp chất ion không dẫn điện nhưng dung dịch các hợp chất ion hoà tan trong nước và các hợp chất ion ở trạng thái nóng chảy đều là chất dẫn điện vì khi đó các ion tích điện có thể chuyển động tự do. Đó là đặc điểm của các hợp chất ion.
Bài 3.21 trang 29 Sách bài tập (SBT) Hóa học 10
Dãy gồm các ion \(X^+\),\(Y^-\) và nguyên tử M đều có cấu hình electron \(1s^22s^22p^6\). Xác định X, Y và M.
Hướng dẫn giải
Bài 3.22 trang 29 Sách bài tập (SBT) Hóa học 10
Ba nguyên tử X, Y, Z có tổng điện tích hạt nhân bằng 16, nguyên tử X nhiều hơn nguyên tử Y một e. Tổng số e trong ion (\(YX_3)^-\) là 32. Xác định X, Y, Z.
Hướng dẫn giải
Gọi số e trong mỗi nguyên tử X,Y,Z lần lượt là x,y,z. Theo đề bài ta có hệ phương trình đại số: