Bài 1 trang 112 SGK Hóa học 10 Nâng cao
Trong phản ứng hóa học sau: \(C{l_2} + 6KOH \to KCl{O_3} + 5KCl + 3{H_2}O\)
\(C{l_2}\) đóng vai trò gì ?
A. Chỉ là chất oxi hóa.
B. Chỉ là chất khử.
C. Vừa là chất oxi hóa, vừa là chất khử.
D. Không phải chất oxi hóa, không phải chất khử.
Lời giải chi tiết
\(\mathop {C{l_2}}\limits^0 + 6KOH\,\, \to \,\,K\mathop {Cl}\limits^{ + 5} {O_3} + 5K\mathop {Cl}\limits^{ - 1} + 3{H_2}O\)
Số oxi hóa của \(\mathop {Cl}\limits^0 \) vừa tăng, vừa giảm nên \(C{l_2}\) vừa là chất oxi hóa, vừa là chất khử.
Chọn C.
Bài 2 trang 112 SGK Hóa học 10 Nâng cao
Trong phản ứng hóa học sau: \(3{K_2}Mn{O_4} + 2{H_2}O \to 2KMn{O_4} + Mn{O_2} \)
\(+ 4KOH,\)
nguyên tố mangan:
A. chỉ bị oxi hóa.
B. chỉ bị khử.
C. vừa bị oxi hóa, vừa bị khử.
D. không bị oxi hóa, không bị khử.
Tìm đáp án đúng.
Lời giải chi tiết
\(3{K_2}\mathop {Mn}\limits^{ + 6} {O_4} + 2{H_2}O\,\, \to \,\,2K\mathop {Mn}\limits^{ + 7} {O_4} + \mathop {Mn}\limits^{ + 4} {O_2}\)
\(+ 4KOH\)
Ta thấy số oxi hóa của nguyên tố Mn vừa tăng vừa giảm nên nó vừa là số oxi hóa, vừa là chất khử.
Chọn C.
Bài 3 trang 112 SGK Hóa học 10 Nâng cao
Những câu sau đây là đúng hay sai?
A. Nhiên liệu là chất oxi hóa.
B. Khi đốt cháy hoàn toàn một hiđrocacbon, nguyên tố cacbon chuyền thành cacbon monooxit.
C. Sự chuyển một chất từ trạng thái lỏng sang trạng thái rắn là một biến đổi vật lí tỏa nhiệt.
D. Sự bay hơi là một biến đổi hóa học.
Lời giải chi tiết
Câu đúng là C.
Câu sai là B, D, A.
Khi đốt cháy hoàn toàn một hiđrocacbon, nguyên tố cacbon chuyển thành cacbon đioxit.
Sự bay hơi là sự biến đổi vật lí. Nhiên liệu là chất khử
Bài 4 trang 112 SGK Hóa học 10 Nâng cao
Hãy nêu thí dụ về phản ứng phân hủy tạo ra:
a) Hai đơn chất;
b) Hai hợp chất;
c) Một đơn chất và một hợp chất.
Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa – khử hay không? Giải thích.
Lời giải chi tiết
Phản ứng phân hủy
a) Hai đơn chất: \(2HgO\,\, \to \,\,2Hg + {O_2};\)
\({H_2}S\,\, \to \,\,{H_2} + S\,\)
b) Hai hợp chất: \(Cu{\left( {OH} \right)_2}\,\, \to \,\,CuO + {H_2}O;\)
\(CaC{O_3}\,\, \to \,\,CaO + C{O_2}\)
c) Một đơn chất và một hợp chất:
\(2KCl{O_3}\,\, \to \,\,2KCl + 3{O_2};\)
\(2KN{O_3}\,\, \to \,\,2KN{O_2} + {O_2}\)
Ở a) và c) số oxi hóa của các nguyên tố thay đổi, ở b) số oxi hóa không thay đổi.
Bài 5 trang 112 SGK Hóa học 10 Nâng cao
Hãy nêu ra thí dụ về phản ứng hóa hợp của:
a) Hai đơn chất;
b) Hai hợp chất;
c) Một đơn chất và một hợp chất.
Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa – khử hay không? Giải thích.
Lời giải chi tiết
Phản ứng hóa hợp:
a) Hai đơn chất: \(2{H_2} + {O_2}\,\, \to \,\,2{H_2}O;\)
\(2K + C{l_2}\,\, \to \,\,2KCl\)
b) Hai hợp chất:
\(CaO + {H_2}O\,\, \to \,\,Ca{\left( {OH} \right)_2};\)
\(S{O_3} + {H_2}O\,\, \to \,\,\,{H_2}S{O_4}\)
c) Từ một đơn chất và 1 hợp chất:
\(2S{O_2} + {O_2}\,\, \to \,\,2S{O_3};\)
\(4FeO + {O_2}\,\, \to \,\,2F{e_2}{O_3}\)
Ở a) và c) số oxi hóa của các nguyên tố thay đổi, ở b) số oxi hóa không thay đổi.
Bài 6 trang 113 SGK Hóa học 10 Nâng cao
Hãy nêu thí dụ về phản ứng tạo ra muối:
a) Từ hai đơn chất;
b) Từ hai hợp chất;
c) Từ một đơn chất và một hợp chất.
Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa – khử hay không? Giải thích.
Lời giải chi tiết
Phản ứng tạo muối:
a) Từ hai đơn chất: \(Fe + S\,\, \to \,\,FeS;\)
\(2Na + C{l_2}\,\, \to \,\,2NaCl\)
b) Từ hai hợp chất:
\(HCl + KOH\,\, \to \,\,KCl + {H_2}O;\)
\({K_2}O + C{O_2}\,\, \to \,\,{K_2}C{O_3}\)
c) Từ một đơn chất và một hợp chất:
\(\eqalign{ & Al + 6HN{O_3}\,\, \to \,\,Al{\left( {N{O_3}} \right)_3} + 3N{O_2} \uparrow + 3{H_2}O \cr & C{l_2} + 2KOH\,\, \to \,\,KCl + KClO + {H_2}O \cr} \)
Ở phản ứng a) và c) có sự thay đổi số oxi hóa của các nguyên tố, ở phản ứng b) số oxi hóa không có sự thay đổi số oxi hóa.
Bài 7 trang 113 SGK Hóa học 10 Nâng cao
NaOH có thể được điều chế bằng:
a) Một phản ứng hóa hợp;
b) Một phản ứng thế;
c) Một phản ứng trao đổi.
- Hãy dẫn ra phản ứng hóa học của mỗi trường hợp trên.
- Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa – khử hay không? Giải thích.
Lời giải chi tiết
Phản ứng điều chế NaOH
a) Một phản ứng hóa hợp: \(N{a_2}O + {H_2}O\,\, \to \,\,2NaOH.\)
b) Một phản ứng thế: \(2Na + 2{H_2}O\,\, \to \,\,2NaOH + {H_2} \uparrow \)
c) Một phản ứng trao đổi: \(N{a_2}C{O_3} + Ba{\left( {OH} \right)_2}\,\, \to \,\,2NaOH + BaC{O_3}\)
Ở phản ứng b) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng; phản ứng a) và c) không là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa.
Bài 8 trang 113 SGK Hóa học 10 Nâng cao
Hãy cho biết số oxi hóa của nitơ trong các phân tử và ion dưới đây:
| Đinitơ oxit \({N_2}O,\) | Axit nitric \(HN{O_3}\); | Ion nitrit \(NO_2^ - \); |
| Hiđrazin \({N_2}{H_4}\); | Hiđroxylamin \(N{H_2}OH\); | Amoniac \(N{H_3}\); |
| Nitơ đioxit \(N{O_2}\); | Ion nitrat \(NO_3^ - \); | Ion hiđrazini \({N_2}H_5^ + \) |
| Axit nitrơ \(HN{O_2}\); | Đinitơ pentaoxit \({N_2}{O_5}\); | Ion amoni \(NH_4^ + \) |
| Khí nitơ \({N_2}.\) | Nitơ monooxit NO. | Đinitơ tetraoxit \({N_2}{O_4}.\) |
Lời giải chi tiết
Số oxi hóa của nitơ trong các phân tử và ion là:
\(\eqalign{ & \mathop {{N_2}}\limits^{ + 1} O;\,\,\mathop {{N_2}}\limits^{ - 2} {H_4};\,\,\mathop N\limits^{ + 4} {O_2};\,\,H\mathop N\limits^{ + 3} {O_2};\,\,\mathop {{N_2}}\limits^0 ;\,\,H\mathop N\limits^{ + 5} {O_3}; \cr & \,\,\mathop N\limits^{ - 1} {H_2}OH; \;\mathop N\limits^{ + 5} O_3^ - ;\,\,\mathop {{N_2}}\limits^{ + 5} {O_5};\,\,\mathop N\limits^{ + 2} O;\,\,\mathop N\limits^{ + 3} O_2^ - ;\,\,\mathop N\limits^{ - 3} {H_3};\cr&\,\,\mathop {{N_2}}\limits^{ - 2} H_5^ + ;\,\,\mathop {{N_2}}\limits^{ + 4} {O_4};\,\,\mathop N\limits^{ - 3} H_4^ + \cr} \)
Bài 9 trang 113 SGK Hóa học 10 Nâng cao
Lập phương trình hóa học của các phản ứng oxi hóa – khử dưới đây:
\(\eqalign{ & a)\,\,NaClO + KI + {H_2}S{O_4} \to {I_2} + NaCl + {K_2}S{O_4} \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ {H_2}O \cr & b)\,\,C{r_2}{O_3} + KN{O_3} + KOH \to {K_2}Cr{O_4} + KN{O_2} \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ {H_2}O \cr & c)\,\,Al + F{e_3}{O_4} \to A{l_2}{O_3} + Fe \cr & d)\,\,Fe{S_2} + {O_2} \to F{e_2}{O_3} + S{O_2} \cr & e)\,\,Mg + HN{O_3} \to Mg{\left( {N{O_3}} \right)_2} + N{H_4}N{O_3}\cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; + {H_2}O. \cr} \)
Lời giải chi tiết
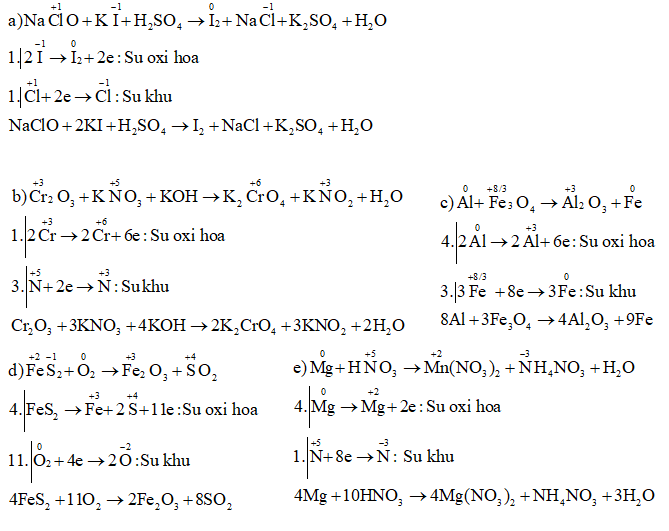
Bài 10 trang 113 SGK Hóa học 10 Nâng cao
Hoàn thành các phương trình hóa học dưới đây:
\(\eqalign{ & a)\,\,KMn{O_4} + HCl \to C{l_2} + MnC{l_2} + ... \cr & b)\,\,S{O_2} + HN{O_3} + {H_2}O \to NO + ... \cr & c)\,\,A{s_2}{S_3} + HN{O_3} + {H_2}O \to {H_3}As{O_4} + NO \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;+ {H_2}S{O_4}. \cr} \)
Lời giải chi tiết

Bài 11 trang 113 SGK Hóa học 10 Nâng cao
Cho kali iotua tác dụng với kali pemanganat trong dung dịch axit sunfuric, người ta thu được 1,2 g mangan (II) sunfat.
a) Tính số gam iot tạo thành.
b) Tính khối lượng kali iotua tham gia phản ứng.
Lời giải chi tiết
a) Tính số gam iot tạo thành.
Phản ứng xảy ra:
\(10KI + 2KMn{O_4} + 8{H_2}S{O_4}\,\, \to \,\,6{K_2}S{O_4} \)
\(+ 2MnS{O_4} + 5{I_2} + 8{H_2}O\,\,\,\,\,\left( 1 \right)\)
Ta có: \({n_{MnS{O_4}}} = {{1,2} \over {151}}\,\,mol\)
Theo (1): \({n_{{I_2}}} = {5 \over 2}{n_{MnS{O_4}}} = {5 \over 2}.{{1,2} \over {151}} \approx 0,02\,\,mol\)
\( \Rightarrow \) Khối lượng iot tạo thành là: \(0,02.254 = 5,08\,\,gam.\)
b) Tính khối lượng kali iotua tham gia phản ứng:
Từ (1)\( \Rightarrow {n_{KI}} = 5{n_{MnS{O_4}}} = 5.{{1,2} \over {151}} \approx 0,04\,\,mol\)
Khối lượng kali iotua tham gia phản ứng là: \({m_{KI}} = 0,04.166 = 6,64\,\,\left( {gam} \right).\)
Được cập nhật: 9 giờ trước (15:20:22) | Lượt xem: 493




